Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Gọi \(n_{Cu}=a\left(mol\right)\rightarrow n_{Fe}=\dfrac{3}{2}a=1,5a\left(mol\right)\)
PTHH:
\(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
a<------a<------a
\(Fe_3O_4+4H_2\xrightarrow[]{t^o}3Fe+4H_2O\)
0,5a<-----2a<------1,5a
\(\rightarrow80a+0,5a.232=39,2\\ \Leftrightarrow a=0,2\left(mol\right)\)
\(\rightarrow\left\{{}\begin{matrix}m_{CuO}=0,2.80=16\left(g\right)\\m_{Fe_3O_4}=0,5.0,2.232=23,2\left(g\right)\end{matrix}\right.\)
b) \(V_{H_2}=\left(0,2.2+0,2\right).22,4=13,44\left(l\right)\)

a) PTHH : \(2Al+6HCl-->2AlCl_3+3H_2\) (1)
\(Fe+2HCl-->FeCl_2+H_2\) (2)
\(H_2+CuO-t^o->Cu+H_2O\) (3)
b) Ta có : \(m_{CR\left(giảm\right)}=m_{O\left(lay.di\right)}\)
=> \(m_{O\left(lay.di\right)}=32-26,88=5,12\left(g\right)\)
=> \(n_{O\left(lay.di\right)}=\frac{5,12}{16}=0,32\left(mol\right)\)
Theo pthh (3) : \(n_{H_2\left(pứ\right)}=n_{O\left(lay.di\right)}=0,32\left(mol\right)\)
=> \(tổng.n_{H_2}=\frac{0,32}{80}\cdot100=0,4\left(mol\right)\)
Đặt \(\hept{\begin{cases}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{cases}}\) => \(27a+56b=11\left(I\right)\)
Theo pthh (1) và (2) : \(n_{H_2\left(1\right)}=\frac{3}{2}n_{Al}=\frac{3}{2}a\left(mol\right)\)
\(n_{H_2\left(2\right)}=n_{Fe}=b\left(mol\right)\)
=> \(\frac{3}{2}a+b=0,4\left(II\right)\)
Từ (I) và (II) => \(\hept{\begin{cases}a=0,2\\b=0,1\end{cases}}\)
=> \(\hept{\begin{cases}m_{Al}=27\cdot0,2=5,4\left(g\right)\\m_{Fe}=56\cdot0,1=5,6\left(g\right)\end{cases}}\)

Đổi 2,016 dm3 = 2,016 l
nH2 = 2,016/22,4 = 0,09 (mol)
Gọi nFe2O3 = a (mol); nCuO = b (mol)
160a + 80b = 5,6 (g) (1)
PTHH:
Fe2O3 + 3H2 -> (t°) 2Fe + 3H2O
Mol: a ---> 3a ---> 2a ---> 3a
CuO + H2 -> (t°) Cu + H2O
Mol: b ---> b ---> b ---> b
3a + b = 0,09 (mol) (2)
Từ (1) và (2) => a = 0,02 (mol); b = 0,03 (mol)
mFe2O3 = 0,02 . 160 = 3,2 (g)
mCuO = 0,03 . 80 = 2,4 (g)
mH2O = (0,02 . 3 + 0,03) . 18 = 1,62 (g)
mFe = 2 . 0,02 . 56 = 2,24 (g)
mCu = 0,03 . 64 = 1,92 (g)

a) Đặt \(n_{Cu}=a\left(mol\right)\)
\(\rightarrow n_{Fe}=1,5a\left(mol\right)\)
PTHH:
\(Fe_3O_4+4H_2\xrightarrow[]{t^o}3Fe+4H_2O\)
0,5a<---2a<------1,5a
\(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
a------>a------->a
Theo bài ra, ta có PT: \(0,5a.232+80a=39,2\)
\(\Leftrightarrow a=0,2\left(mol\right)\)
\(\rightarrow\left\{{}\begin{matrix}m_{Fe_3O_4}=0,5.0,2.232=23,2\left(g\right)\\m_{CuO}=0,2.80=16\left(g\right)\end{matrix}\right.\)
b) \(V_{H_2}=\left(0,2.2+0,2\right).22,4=13,44\left(l\right)\)

Fe3O4+4H2-to>3Fe+4H2O
x---------\(\dfrac{3}{4}x\)
CuO+H2-to>Cu+H2O
y--------y mol
Ta có :
\(\left\{{}\begin{matrix}x+y=0,5\\\dfrac{3}{4}x.56+64y=23,2\end{matrix}\right.\)
=>x=0,4 mol, y=0,1 mol
=>% m Fe3O4=\(\dfrac{0,4.232}{0,4.232+0,1.80}.100\)=92,1%
=>%m CuO=100-92,1=7,9%
\(n_{H_2}=\dfrac{11,2}{22,4}=0,5mol\)
\(Fe_3O_4+4H_2\rightarrow3Fe+4H_2O\)
x 4x 3x
\(CuO+H_2\rightarrow Cu+H_2O\)
y y y
\(\Rightarrow\left\{{}\begin{matrix}4x+y=0,5\\3\cdot56x+64y=23,2\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(\%m_{Fe_2O_3}=\dfrac{0,1\cdot232}{0,1\cdot232+0,1\cdot80}\cdot100\%=74,36\%\)
\(\%m_{CuO}=100\%-74,36\%=25,64\%\)

Phương trình hóa học:
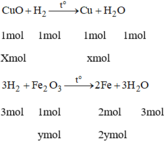
Gọi x là số mol của CuO
y là số mol của F e 2 O 3 .
Ta có: 80x + 160y = 16 (1)
Khối lượng hỗn hợp giảm do oxit tạo thành kim loại:
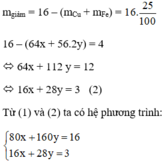
Giải hệ phương trình ta được:
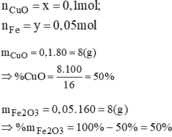
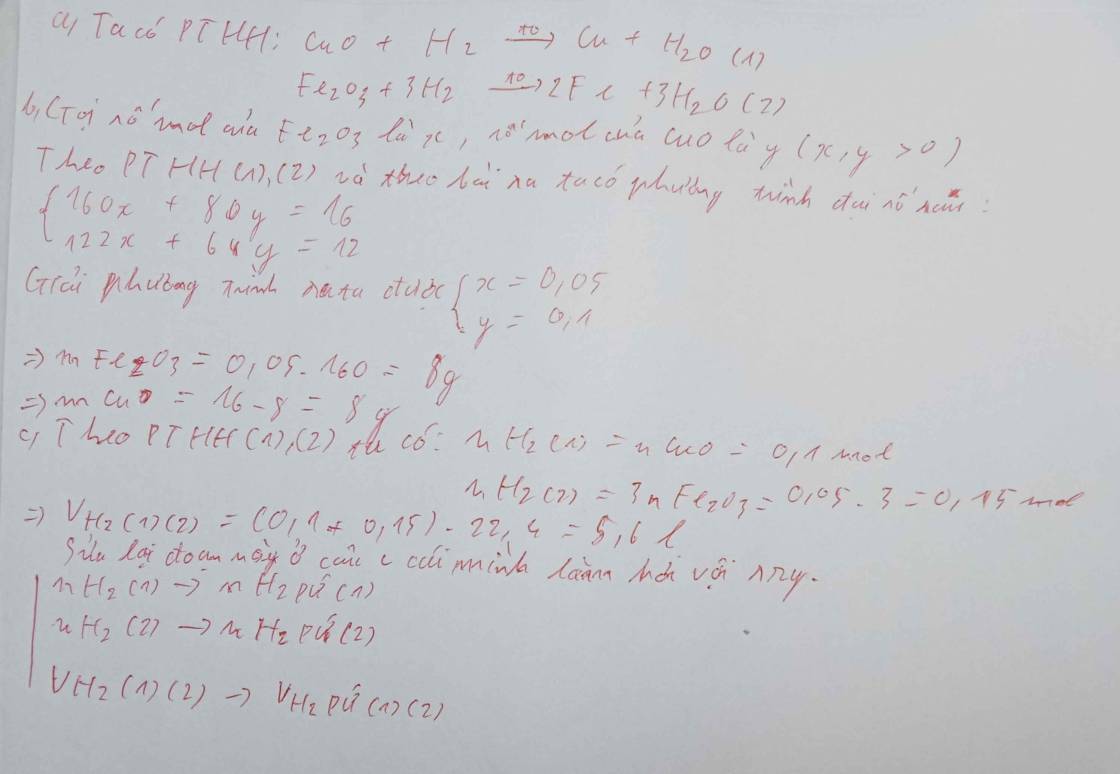

\(a) n_{Fe_3O_4} = a(mol) ; n_{CuO} = b(mol)\\ \Rightarrow 232a + 80b = 117,6(1)\\ Fe_3O_4 + 4H_2 \xrightarrow{t^o} 3Fe + 4H_2O\\ CuO + H_2 \xrightarrow{t^o} Cu + H_2O\\ n_{H_2} = 4a + b = \dfrac{40,32}{22,4}=1,8(2)\\ (1)(2)\Rightarrow a = 0,3 ;b = 0,6\\ \%m_{Fe_3O_4} = \dfrac{0,3.232}{117,6}.100\% =59,18\%\\ \%m_{CuO} = 100\%-59,18\% = 40,82\%\)
\(b)\\ n_{Fe} = 3a = 0,9(mol)\\ n_{Cu} = b = 0,6(mol)\\ \%m_{Fe} = \dfrac{0,9.56}{0,9.56+0,6.64}.100\% = 56,76\%\\ \%m_{Cu} = 100\% - 56,76\% = 43,24\%\)