Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1/ a, Theo đề bài ta có
nH2SO4=0,5 mol
\(\Rightarrow\) mH2SO4=0,2.98=19,6 g
mdd=mct+mdm=19,6 + 151=170,6 g
\(\Rightarrow\) Nồng độ % của dung dịch là
C%=\(\dfrac{mct}{mdd}.100\%=\dfrac{19,6}{170,6}.100\%\approx11,49\%\)
b, Theo đề bài ta có
VH2O=280 ml \(\Rightarrow\) mH2O=280 g
mdd = mct + mdm = 20 +280 = 300 g
\(\Rightarrow\) C%= \(\dfrac{mct}{mdd}.100\%=\dfrac{20}{300}.100\%\approx6,67\%\)
5/ * Phần tính toán
Ta có
Số mol của NaOH có trong 500ml dung dịch NaOH 1M là
nNaOH=CM.V=0,5.1=0,5 mol
\(\Rightarrow\) Khối lượng của NaOH cần dùng là
mNaOH = 0,5 .40 =20 g
\(\Rightarrow\) Khối lượng của dung dịch NaOH là
mddNaOH=\(\dfrac{mct.100\%}{C\%}=\dfrac{20.100\%}{25\%}=80g\)
Ta có công thức
m=D.V
\(\Rightarrow\) V=\(\dfrac{m}{D}=\dfrac{80}{1,2}\approx66,67ml\)

a) Khối lượng H2SO4 là: m = 10 g
Nồng độ phần trăm dung dịch H2SO4 sau khi pha loãng là:
C% = . 100% = 20%
b) Thể tích dung dịch H2SO4 là: V = 45,45 ml
Số mol của H2SO4 là: n = 0,102 mol
Nồng độ mol của dung dịch H2SO4 sau khi pha loãng:
CM = = 2,24 (mol/lít)

a, Số gam chất tan có trong 100d H2O:
\(m_{ct\left(trong-100g-H_2O\right)}=\dfrac{100.25}{150}=\dfrac{50}{3}\approx16,667\left(g\right)\)
b, Số gam chất tan có trong 100g dd:
\(m_{ct\left(trong-100g-dd\right)}=\dfrac{100.25}{150+25}\approx14,286\left(g\right)\)
a)
25g NaCl hòa với 150g H2O
x(g) NaCl hòa với 100g H2O
=> x=16,666gam
b)
trong 175g dung dịch có 25g NaCl
=> 100g dung dịch có y gam NaCl
=>y= 14,29

Lần sau đăng 2-3 bài 1 lần thôi nha
----------------------------
1. \(n_{AgNO_3}=1.0,02=0,02\left(mol\right)\)
\(n_{HCl}=0,15.0,5=0,075\left(mol\right)\)
Pt: \(AgNO_3+HCl\rightarrow AgCl+HNO_3\)
0,02mol 0,075mol \(\rightarrow0,02mol\)
Lập tỉ số: \(n_{AgNO_3}:n_{HCl}=0,02< 0,075\)
\(\Rightarrow AgNO_3\) hết; HCl dư
\(n_{HCl\left(dư\right)}=0,075-0,02=0,055\left(mol\right)\)
\(\Sigma_{V\left(spu\right)}=0,02+0,15=0,17\left(l\right)\)
\(C_{M_{HCl}}=\dfrac{0,055}{0,17}=0,32M\)
\(C_{M_{HNO_3}}=\dfrac{0,02}{0,17}=0,12M\)
\(m_{AgNO_3}=D.V=1,1.20=22\left(g\right)\)
\(m_{HCl}=D.V=1,05.150=157,5\left(g\right)\)
\(m_{AgCl}=0,02.143,5=2,87\left(g\right)\)
\(\Sigma_{m_{\left(spu\right)}}=22+157,5-2,87=176,63\left(g\right)\)
\(C\%_{HCl\left(dư\right)}=\dfrac{0,055.36,5.100}{176,63}=1,13\%\)
\(C\%_{HNO_3}=\dfrac{0,02.63.100}{176,63}=0,71\%\)
3.Pt: \(MgO+2HCl\rightarrow MgCl_2+H_2O\)
40 73 95
a \(\rightarrow\) \(\dfrac{73}{40}a\) \(\rightarrow\) \(\dfrac{95}{40}a\)
Ta có : \(\dfrac{95}{40}a=a+55\)
\(\Rightarrow a=40\)
\(m_{ct}=\dfrac{m.3,65}{100}\)(1)
\(m_{HCl}=\dfrac{73}{40}.40=73\left(g\right)\)(2)
(1)(2)\(\Rightarrow\dfrac{m.3,65}{100}=73\)
\(\Rightarrow m=2000\)
\(C\%_{MgCl_2}=\dfrac{a+55}{a+m}.100=\dfrac{40+55}{40+2000}.100=4,65\%\)

Bài 3:
Gọi x (g) là khối lượng của đ H2SO4 10%
\(m_{H_2SO_4}=\dfrac{150.25\%}{100\%}=37,5\left(g\right)\)
\(m_{H_2SO_4}=\dfrac{x.10\%}{100\%}=\dfrac{x}{10}\)
\(C\%_{ddH_2SO_4}=\dfrac{37,5+\dfrac{x}{10}}{150+x}.100\%=15\%\)
\(\Rightarrow x=300\left(g\right)\)
Vậy cần trộn 300(g) dung dịch H2SO4 10% với 150 gam dung dịch H2SO425% để thu được dung dịch H2SO4 15%.
Bài 2 :
a) \(m_{ct}=\dfrac{80.15\%}{100\%}=12\left(g\right)\)
\(C\%=\dfrac{12}{20+80}.100\%=12\%0\)
b)\(m_{ct}=\dfrac{200.20\%}{100\%}+\dfrac{300.5\%}{100\%}=55\left(g\right)\)
\(C\%=\dfrac{55}{200+300}.100\%=11\%\)
c) \(m_{ct}=\dfrac{100.a\%}{100\%}+\dfrac{50.10\%}{100\%}=\dfrac{100.a\%}{100\%}+5\left(g\right)\)
\(C\%=\dfrac{\dfrac{100.a\%}{100\%}+5}{100+50}.100\%=7,5\%\)
\(\Rightarrow a\%=6,25\%\)

a) mBaCl2 = \(\dfrac{20.208}{100}=41,6\) (g)
=> nBaCl2 \(\dfrac{41,6}{208}=0,2\) mol
nFe2(SO4)3 \(\dfrac{20}{400}=0,05\) mol
Pt: 3BaCl2 + Fe2(SO4)3 --> 3BaSO4 + 2FeCl3
0,15 mol---> 0,05 mol------> 0,15 mol-> 0,1 mol
Xét tỉ lệ mol giữa BaCl2 và Fe2(SO4)3:
\(\dfrac{0,2}{3}>\dfrac{0,05}{1}\)
Vậy BaCl2 dư
mFeCl3 = 0,1 . 162,5 = 16,25 (g)
mBaCl2 dư = (0,2 - 0,15) . 208 = 10,4 (g)
mBaSO4 = 0,15 . 233 = 34,95 (g)
mdd sau pứ = mdd BaCl2 + mFe2(SO4)3 - mBaSO4
....................= 208 + 20 - 34,95 = 193,05 (g)
C% dd FeCl3 = \(\dfrac{16,25}{193,05}.100\%=8,42\%\)
C% dd BaCl2 dư = \(\dfrac{10,4}{193,05}.100\%=5,4\%\)
b) Pt: FeCl3 + 3NaOH --> Fe(OH)3 + 3NaCl
........0,1 mol---------------> 0,1 mol
..........2Fe(OH)3 --to--> Fe2O3 + 3H2O
..........0,1 mol----------> 0,05 mol
mFe2O3 = 0,05 . 160 = 8 (g)
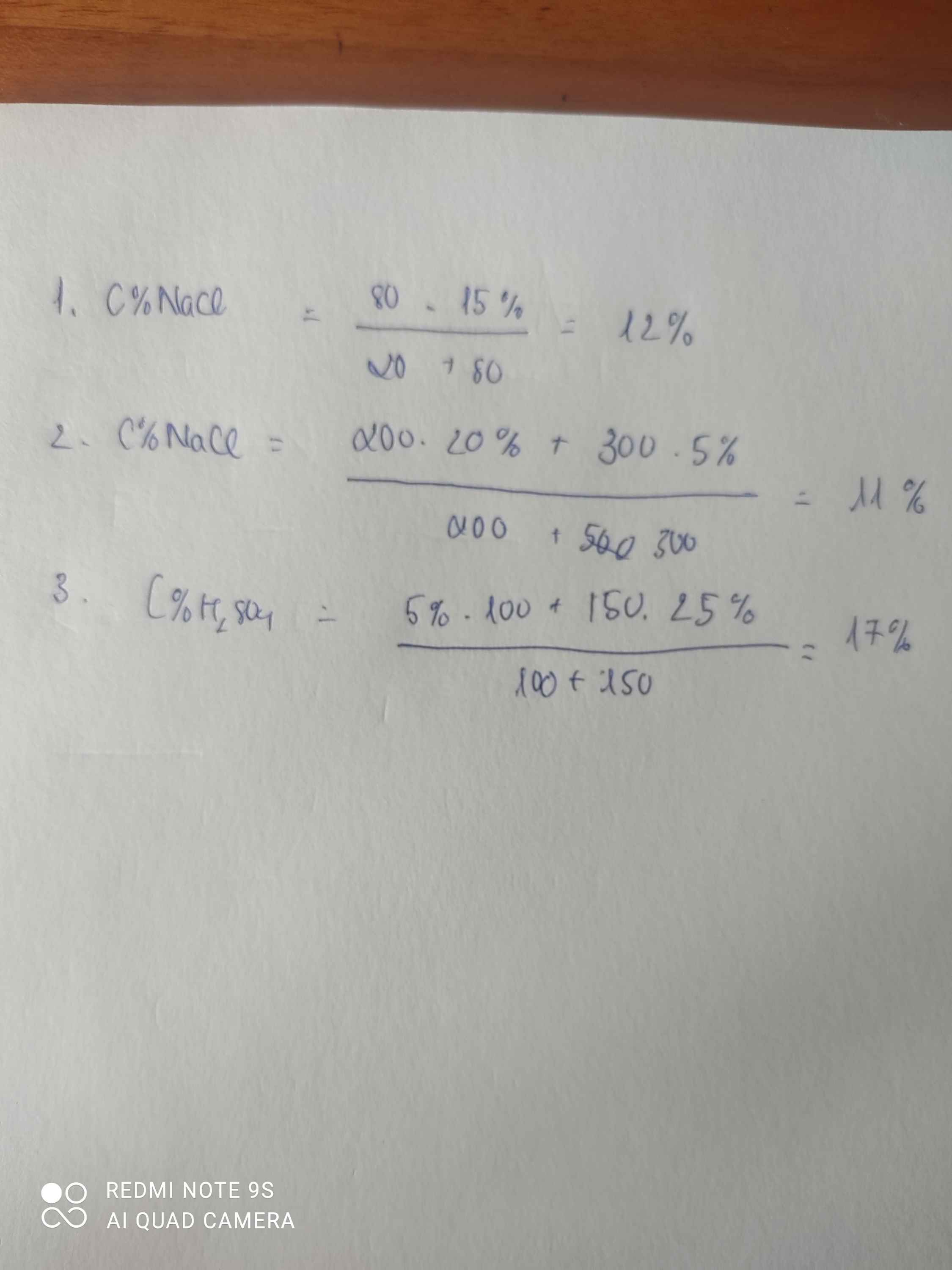
Sau khi pha trộn thì mct ko đổi áp dụng công thức C%=mct/mdd*100%
Do đó mct=20/100*X(trước)=10/100*(X+100)(sau)
Giải pt ta có:2*X=X100
Vậy X=100g .
Tick hộ mk nha??>>>