Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Cho V lít SO2 (đktc) sục vào 310ml dd Ca(OH)2 1M. Sau phản ứng khối lượng dd tăng lên 15,52g. Tính V

nCa(OH)2 = 0.31 mol
TH1: Chỉ tạo ra CaSO3
Đặt : nSO2 = x mol
Ca(OH)2 + SO2 --> CaSO3 + H2O
___________x_______x
m dd tăng = mCaSO3 - mSO2 = 15.52
<=> 120x - 64x = 15.52
<=> x = 0.28
VSO2 = 6.272 (l)
TH2 : Tạo ra hai muối
Ca(OH)2 + SO2 --> CaSO3 + H2O
0.28_______0.28____0.28
=> nCa(OH)2 (cl) = 0.03 mol
Ca(OH)2 + 2SO2 --> Ca(HSO3)2
0.03________0.06
VSO2 = ( 0.28+0.06) *22.4 = 7.616 (l)

\(SO_2+Ca\left(OH\right)_2\rightarrow CaCo_3+H_2O\)
0,2mol 0,2mol 0,2mol 0,2mol
\(n_{Ca\left(OH\right)_2}=C_M.V=1.0,2=0,2mol\)
\(V_{SO_2}=n.22,4=0,2.22,4=4,48l\)
vậy thể tích SO2 là 4,48 lít

nCH4 = 11.2/22.4 = 0.5 (mol)
CH4 + 2O2 -to-> CO2 + 2H2O
0.5____________0.5
CO2 + Ca(OH)2 => CaCO3 + H2O
0.5_______________0.5
mCaCO3 = 0.5*100 = 50 (g)

4.
- Lấy mẫu thử và đánh dấu
- Cho quỳ tím vào các mẫu thử
+ Mẫu thử làm quỳ tím hóa xanh chất ban đầu là Ca(OH)2
+ Mẫu thử làm quỳ tím hóa đỏ chất ban đầu là HCl
+ Mẫu thử không làm quỳ tím chuyển màu chất ban đầu là BaCl2
1.
nZn = 0,5 mol
Zn + 2HCl \(\rightarrow\) ZnCl2 + H2
\(\Rightarrow\) VH2 = 0,5.22,4 = 11,2 (l)
\(\Rightarrow\) mZnCl2 = 0,5.136 = 68 (g)

\(n_{CO_2}=\frac{6,72}{22,4}=0,3\left(mol\right)\\ n_{Ca\left(OH\right)_2}=1.0,25=0,25\left(mol\right)\\ \rightarrow n_{OH}=0,5\left(mol\right)\\ TL:\frac{n_{OH}}{n_{CO_2}}=\frac{0,5}{0,3}=1,6\)
→ Tạo ra hh 2 muối
\(n_{CaCO_3}=x;n_{Ca\left(HCO_3\right)_2}=y\)
\(PTHH:Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
\(PTHH:Ca\left(OH\right)_2+2CO_2\rightarrow Ca\left(HCO_3\right)_2\)
\(\Rightarrow hpt:\left\{{}\begin{matrix}x+y=0,25\\x+2y=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,05\end{matrix}\right.\)
\(m_{spu}=100.0,2+0,05.162=28,1\left(g\right)\)
nhờ anh vào trang của em rồi trả lời mấy câu hỏi của em cái. Thank anh!

1. n\(_{Ba}\)= \(\dfrac{13,7}{137}\)= 0,1(mol)
n\(O_2\)=\(\dfrac{4,48}{22,4}\)= 0,2(mol)
2Ba+ O\(_2\)\(\rightarrow\)2BaO
Đề bài: 2 1
Pt: 0,1 0,2 (mol)
So sánh: \(\dfrac{n_{Đb}}{n_{Pt}}\)=\(\dfrac{0,1}{2}< \dfrac{0,2}{1}\). Vậy số mol của oxi dư bài toán tính theo số mol của Ba.
\(m_{O_2}\)= 0,2. 32= 6,4(g)
2Ba+ O\(_2\)\(\rightarrow\)2BaO
0,1\(\rightarrow\)0,05 (mol)
\(m_{O_2}\)= 0,05. 32= 1,6(g)
\(m_{O_2}\)(dư)= 6,4-1,6=4,8(g)
3. Đổi: 100(ml)= 0,1(l)
n\(_{Fe}\)=\(\dfrac{5,6}{56}\)= 0,1(mol)
n\(_{HCl}\)= 3.0,1= 0,3(mol)
Fe+ 2HCl\(\rightarrow\)\(FeCl_2\)+ H\(_2\)
Đb: 1 2
Pt: 0,1 0,3 (mol)
S\(^2\): \(\dfrac{n_{Đb}}{n_{Pt}}\)= \(\dfrac{0,1}{1}< \dfrac{0,3}{2}\). Vậy số mol của HCl dư bài toán tính theo số mol của Fe
m\(_{HCl}\)=0,3. 36,5= 10,95(g)
Fe+ 2HCl\(\rightarrow\)\(FeCl_2\)+ H\(_2\)
0,1\(\rightarrow\)0,2 (mol)
m\(_{HCl}\)= 0,2. 36,5= 7,3(g)
m\(_{HCl}\)(dư)= 10,95- 7,3= 3,65(g)
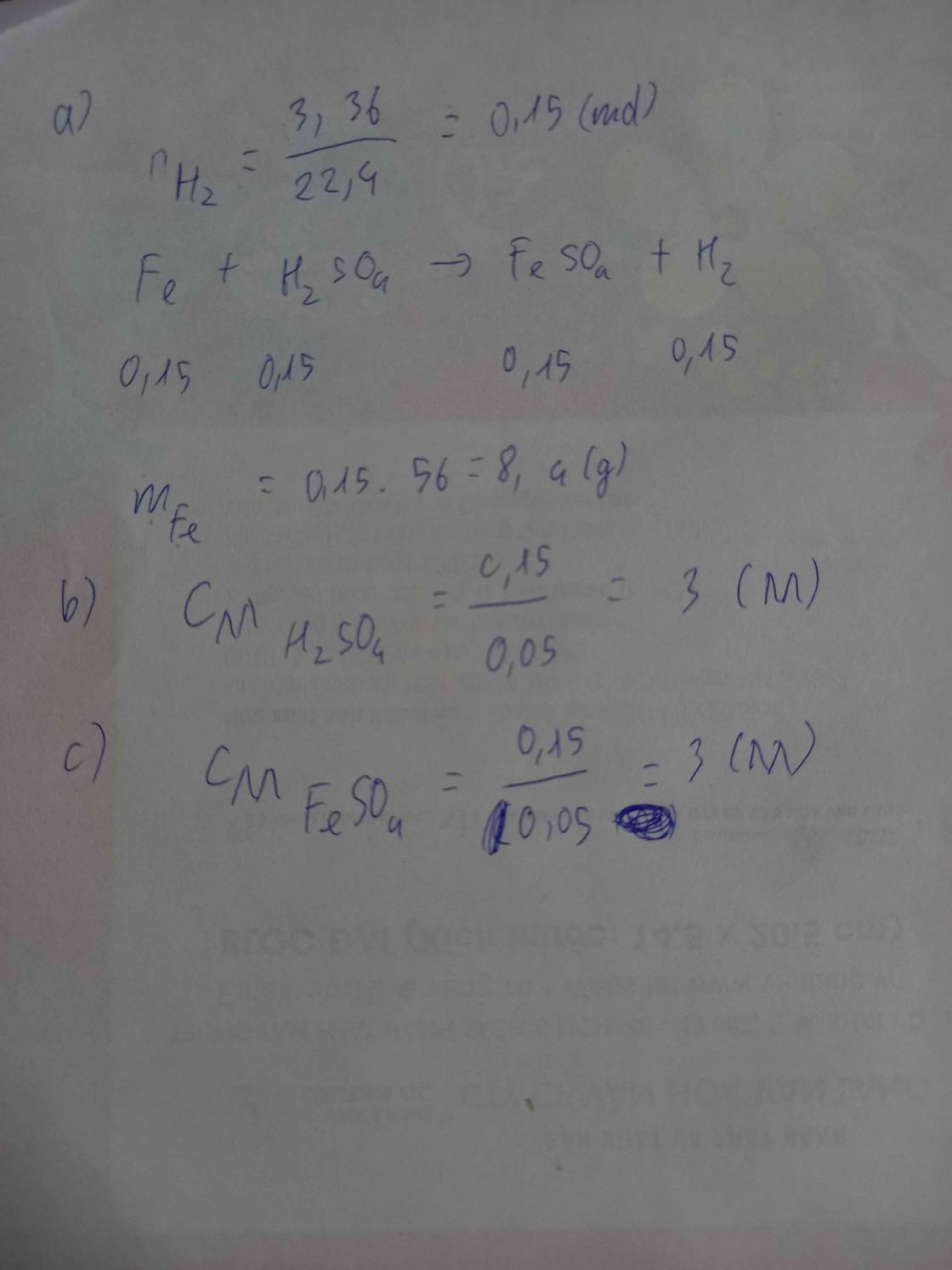
SO2 + Ca(OH)2 -> CaSO3 + H2O
a................................a (mol)
với a = V/22,4 (mol)
Theo bài ra :
\(\Delta m=m_{CáSO3}-m_{SO2}=120a-64a=56a\) = 5,6 (g)
=> a = 0,1(mol)
=> V =2,24(l)
Gọi số mol SO2 là x(mol)
SO2+ Ca(OH)2---> CaSO3+ H2O
x...................................x.(mol)
Có: mCaSO3-mSO2=56x=5,6(g)
=> x=0,1(mol)
=> V=0,1.22,4=2,24(l)