Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D.
Ở catot trong quá trình điện phân là xảy ra quá trình khử (quá trình nhận e)
Số nửa phản ứng xảy ra ở catot trong quá trình điện phân là: 1, 3, 6.

1. Phản ứng nào sau đây thể hiện Cu2+ có tính oxi hoá mạnh hơn Pb2+?
A. Cu + Pb2+ → Cu2+ + Pb. B. Pb + Cu2+ → Pb2+ + Cu.
C. Pb→ Pb2+ + 2e ; Cu2+ + 2e → Cu D. Cu2+ + Fe → Fe2+ + Cu

Đáp án B
- Dựa vào quy tắc α ta xác định được các cặp chất có phản ứng Zn, Ag với Fe2+ là . Phản ứng:
Zn + Fe2+ → Zn2+ +Fe
Fe2+ + Ag+ → Fe3+ + Ag

Đáp án C
Các kim loại có tính khử mạnh hơn Zn mới khử được ion Zn2+.
Theo dãy điện hóa các kim loại đứng trước Zn có tính khử mạnh hơn: Mg, Al, Cr.

Cho 4 cặp oxi hoá khử sau: Fe2+/ Fe; Fe3+/Fe2+; Cu2+/ Cu; 2H+/ H2.
Thứ tự tính oxi hoá tăng dần của các cặp trên là:
A. Fe2+/ Fe; Fe3+/Fe2+; 2H+/ H2; Cu2+/Cu
B. Fe2+/ Fe; Cu2+/ Cu; 2H+/ H2; Fe3+/Fe2+.
C. Fe2+/ Fe; 2H+/ H2; Fe3+/Fe2+; Cu2+/Cu
D. Fe2+/ Fe; 2H+/ H2 ; Cu2+/ Cu; Fe3+/Fe2+;
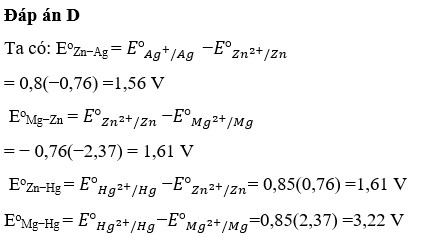
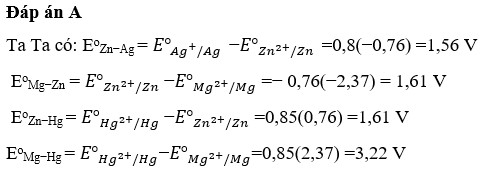

Trong một pin điện hoá tạo bởi các cặp oxi hóa - khử Zn2+/ZnZn2+/Zn và Cu2+/CuCu2+/Cu ở điều kiện chuẩn, quá trình xảy ra ở cực dương là quá trình oxi hóa.
Ở cực dương, xảy ra phản ứng oxi hóa (mất electron). Trong cặp Zn2+/ZnZn2+/Zn, kẽm (ZnZn) sẽ mất electron để tạo thành ion Zn2+Zn2+. Vì vậy, phản ứng xảy ra ở cực dương là:
Zn→Zn2++2�−Zn→Zn2++2e−Do đó, đáp án đúng là:
A. Zn → Zn²⁺ + 2e
Ở cực âm của pin, quá trình khử xảy ra, và ion Cu2+Cu2+ sẽ nhận electron để chuyển thành đồng kim loại CuCu.
D