Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đổ dung dịch chứa 1g HBr vào dung dịch chứa 1g NaOH. Nhúng giấy quỳ tím vào dung dịch thu được thì giấy quỳ tím chuyển sang màu nào?
A. Màu đỏ
B. Màu xanh
C. Không đổi màu
D. Không xác định được

Chọn D
D sai vì sản phẩm sinh ra là sắt (II) sunfat.
Fe + CuSO4 → FeSO4 + Cu

a, Cứ 1 mol sắt tan trong dd thì sẽ có 1 mol Cu bám vào thanh sắt ⇒ Khối lượng tăng 8g
Vậy khi khối lượng tăng 0,8g thì nCu = nFe = 0.1 (mol)
⇒ mCu trên thanh sắt = 6,4 (g)
b, Các chất tan trong A: CuSO4; FeSO4
V = 500 ml = 0,5 (l)
nCuSO4 ban đầu = 0,5 (mol)
nCuSO4 phản ứng = 0,1 (mol)
⇒ nCuSO4 trong dd = 0,4 (mol)
⇒ CMCuSO4 = 0.8 (M)
nFeSO4 = nFe = 0,1 (mol)
⇒ CMFeSO4 = 0,2 (M)
PTHH: \(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
a) Gọi số mol Fe phản ứng là \(x\) \(\Rightarrow n_{Cu}=x\left(mol\right)\)
Ta có: \(64x-56x=0,8\) \(\Leftrightarrow x=0,1\)
\(\Rightarrow m_{Cu\left(bámvào\right)}=0,1\cdot64=6,4\left(g\right)\)
b) Ta có: \(n_{CuSO_4}=0,5\cdot1=0,5\left(mol\right)\)
\(\Rightarrow n_{CuSO_4\left(dư\right)}=0,5-0,1=0,4\left(mol\right)\)
Mặt khác: \(n_{FeSO_4}=0,1mol\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{CuSO_4}}=\dfrac{0,4}{0,5}=0,8\left(M\right)\\C_{M_{FeSO_4}}=\dfrac{0,1}{0,5}=0,2\left(M\right)\end{matrix}\right.\)

1.
* Thí nghiệm 1: Fe + CuSO4 → FeSO4 + Cu
Quá trình oxi hóa: Fe0 → Fe+2 + 2e
Quá trình khử: Cu+2 + 2e → Cu0
* Thí nghiệm 2: Fe + H2SO4 → FeSO4 + H2
Quá trình oxi hóa: Fe0 → Fe+2 + 2e
Quá trình khử: 2H+ + 2e → H20
2.
* Thí nghiệm 1:
- Chất oxi hóa CuSO4
- Chất khử Fe
* Thí nghiệm 2:
- Chất oxi hóa H2SO4
- Chất khử Fe

Câu 1 :
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
x______2x______x________x__(mol)
\(Al+2HCl\rightarrow AlCl_3+\frac{3}{2}H_2\)
y_____2y______y______3/2y__(mol)
\(n_{khí}=\frac{11,2}{22,4}=0,5\left(mol\right)\)
\(\left\{{}\begin{matrix}24x+27y=10,2\\x+\frac{3}{2}y=0,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,2\end{matrix}\right.\)
\(\%m_{Mg}=\frac{10,2-\left(24.0,2\right)}{0,2}.100\%=52,94\%\)
\(\%m_{Al}=100\%-52,94\%=47,06\%\)
\(m_{muoi}=95.0,2+133,5.0,2=28,6\left(g\right)\)
\(V_{HCl}=1,6\left(l\right)\)
Dùng 7,5% \(\Rightarrow V=1,6-1,6.7,5\%=1,48\left(l\right)\)
Câu 2:
\(FeCl_2+2AgNO_3\rightarrow Fe\left(NO_3\right)_2+2AgCl\)
\(n_{FeCl2}=0,2.1=0,2\left(mol\right)\)
\(\Rightarrow n_{AgCl}=2n_{FeCl2}=2.0,2=0,4\left(mol\right)\)
\(m_{AgCl}=0,4.143,5=57,4\left(g\right)\)
\(n_{Fe\left(NO3\right)2}=n_{FeCl2}=0,2\left(mol\right)\)
V dd sau phản ứng= VFeCl2 + VAgNO3 = 0,2+0,3= 0,5 (l)
\(\Rightarrow CM_{FeCl2}=\frac{0,2}{0,5}=0,4M\)

Fe + 2H+ → Fe2+ + H2↑
Fe2O3 + 6H+ → 2Fe3+ + 3H2O
25ml dd phản ứng với 12,5ml dd KMnO4 0,096M
→ 500ml dd phản ứng với
\(\frac{500.12,5}{25}\) = 250ml dd KMnO4 0,096M
nKMnO4 phản ứng với 500ml dd = 0,096 . 0,25 = 0,024 mol
Fe+2 → Fe+3 + 1e M+7 + 5e → Mn+2
0,12 ← 0,12 0,12←0,024
(Bảo toàn e)
nFe = nFe2+ = 0,12 mol
\(\%m_{Fe}=\frac{0,12.56}{7,81}.100\%=93,59\%\)
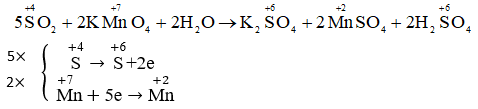
Chọn B
Hiện tượng quan sát được: Có lớp đồng màu đỏ bám ngoài đinh Fe.
PTHH: Fe + CuSO4 → FeSO4 + Cu (đỏ).