Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Ta có: nH2=4,48/22,4=0,2(mol)
PTHH: Fe +2 HCl -> FeCl2 + H2
0,2________0,4______0,2__0,2(mol)
mFe=0,2.56=11,2(g)
=> %mFe= (11,2/17,6).100=63,636%
=> %mCu= 36,364%
b) Fe2O3 + 3 H2 -to-> 2 Fe + 3 H2O
Ta có: nH2=0,2(mol) => nFe=2/3. 0,2= 2/15(mol)
=> mFe= 2/15 . 56=7,467(g)
Số moll của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,2 0,2
a) Số mol của sắt
nFe = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,2. 56
= 11,2 (g)
Khối lượng của đồng
mCu = 17,6 - 11,2
= 6,4 (g)
0/0Fe = \(\dfrac{m_{Fe}.100}{m_{hh}}=\dfrac{11,2.100}{17,6}=63,64\)0/0
0/0Cu = \(\dfrac{m_C.100}{m_{hh}}=\dfrac{6,4.100}{17,6}=36,36\)0/0
b) 3H2 + Fe2O3 → (to) 2Fe + 3H2O\(|\)
3 1 2 3
0,2 0,13
Số mol của sắt
nFe = \(\dfrac{0,2.2}{3}=0,13\left(mol\right)\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,13 . 56
= 7,28 (g)
Chúc bạn học tốt

a) PTHH: Mg +2 HCl -> MgCl2 + H2
nH2=11,2/22,4=0,5(mol)
=> nMg=nMgCl2=nH2=0,5(mol)
m=mMg=0,5.24=12(g)
b) mMgCl2=0,5.95=47,5(g)
mddMgCl2= mMg + mddHCl - mH2= 12+100-0,5.2= 111(g)
=>C%ddMgCl2= (47,5/111).100=42,793%

Số mol của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,2 0,2
a) Số mol của sắt
nFe = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Khối lượng của sắt
mFe = nFe .MFe
= 0,2. 56
= 11,2 (g)
Khối lượng của đồng
mCu = 17,6 - 11,2
= 6,4 (g)
0/0Fe = \(\dfrac{m_{Fe}.100}{m_{hh}}=\dfrac{11,2.100}{17,6}=63,64\)0/0
0/0Cu = \(\dfrac{m_{Cu}.100}{m_{hh}}=\dfrac{6,4.100}{17,6}=36,36\)0/0
b) 3H2 + Fe2O3 → (to) 2Fe + 3H2O\(|\)
3 1 2 3
0,2 0,13
Số mol của sắt
nFe = \(\dfrac{0,2.2}{3}=0,13\left(mol\right)\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,13 . 56
= 7,28 (g)
Chúc bạn học tốt

Thể tích khí H2: 

 Số mol
Số mol
Phương trình:
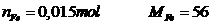


 khối lượng
khối lượng
Vậy m = 0,84gam

a,\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right);n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,15 0,3
Ta có: \(\dfrac{0,2}{1}>\dfrac{0,15}{1}\) ⇒ H2 pứ hết,Fe dư
\(V_{H_2}=3,36\left(l\right)\) (đề cho)
b, ko tính đc k/lg dd ,chỉ tính đc thể tích dd
\(V_{ddHCl}=\dfrac{0,2}{1}=0,2\left(l\right)=200\left(ml\right)\)

nFe = 2.8/56 = 0.05 (mol)
nHCl = 14.6/36.5 = 0.4 (mol)
Fe + 2HCl => FeCl2 + H2
1.........2
0.05......0.4
LTL : 0.05/1 < 0.4/2
=> HCl dư
mHCl (dư) = ( 0.4 - 0.1 ) * 36.5 = 10.95 (g)
VH2 = 0.05*22.4 = 1.12 (l)
nHCl (dư) = 0.4 - 0.1 = 0.3 (mol)
mFe cần thêm = 0.3/2 * 56 = 8.4 (g)

Fe + 2HCl -> FeCl2 + H2
nFe = 5,6/56 = 0,1 mol
=>nH2 = 0,1 mol
=> VH2= 0,1*22,4= 2,24 lít
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: Fe + 2HCl ---> FeCl2 + H2
0,1-->0,2------------------>0,1
=> \(\left\{{}\begin{matrix}m_{ddHCl}=\dfrac{0,2.36,5}{15\%}=\dfrac{146}{3}\left(g\right)\\V_{H_2}=0,1.22,4=4,48\left(l\right)\end{matrix}\right.\)

`Fe + 2HCl -> FeCl_2 + H_2`
`0,2` `0,2` `0,2` `(mol)`
`n_[Fe]=[11,2]/56=0,2(mol)`
`a)m_[FeCl_2]=0,2.127=25,4(g)`
`b)V_[H_2]=0,2.22,4=4,48(l)`
`c)n_[O_2]=[4,48]/[22,4]=0,2(mol)`
`2H_2 + O_2` $\xrightarrow{t^o}$ `2H_2 O`
`0,2` `0,1` `0,2` `(mol)`
Ta có:`[0,2]/2 < [0,2]/1`
`=>O_2` dư
`=>m_[H_2 O]=0,2.18=3,6(g)`

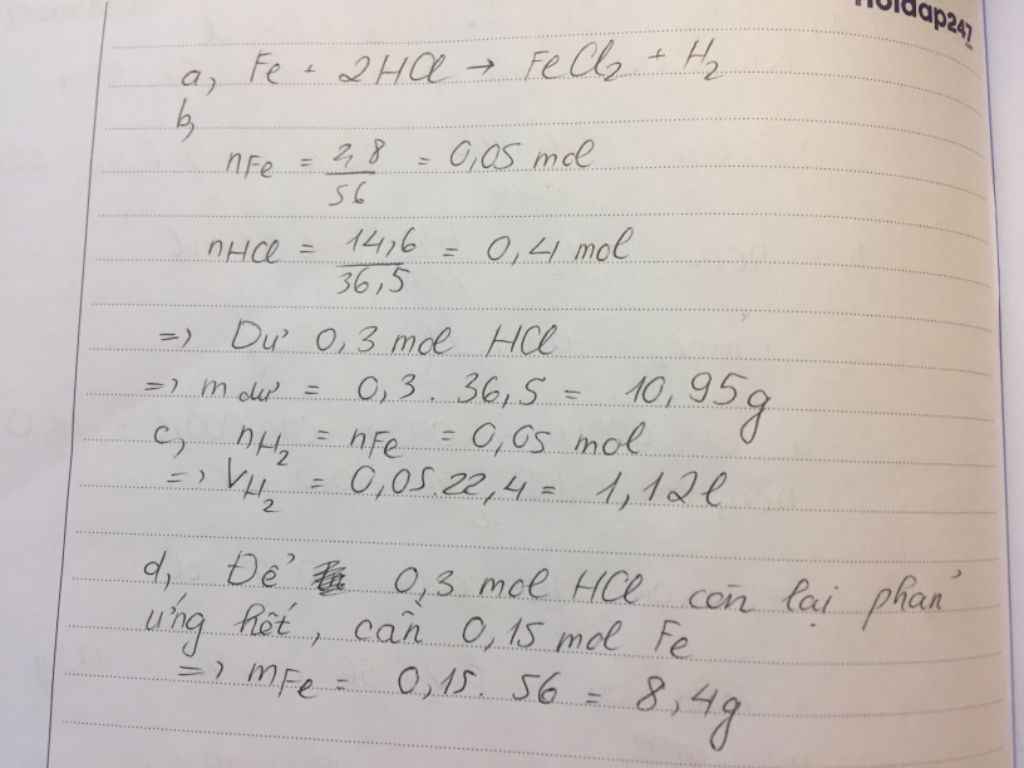
Fe+2HCl->FeCl2+H2
0,015-------------------0,015 mol
n H2=0,336\22,4=0,015 mol
=>m Fe=0,015.56=0,84g
PTHH
Fe + 2HCL --> Fecl2 +H2
TBR, ta có : nH2 = 0,336 / 22,4 = .............(mol) (tự tính)
Theo PTHH, nFe = nH2 = .........(tính trên kia)
=> m Fe = nFe . 56 = (g)