Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{NaOH}=\dfrac{8}{40}=0,2mol\)
\(n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\)\(mol\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
0,2 0,2
Dung dịch thu được là \(Na_2SO_4\) có môi trường trung hòa.

Số mol HCl = 0,08 mol => Số mol nước tạo thành sau pư = 0,08 mol.
BTKL: mmuối = 3,4 + 80. 3,65% - 0,08.18 = 4,88g

Gọi công thức của axit RCOOH
Ta có:
\(n_{NaOH}=0,3.0,5=0,15\left(mol\right)\)
\(PTHH:RCOOH+NaOH\rightarrow RCOONa+H_2O\)
____________0,15______0,15____________
\(\Rightarrow n_{RCOOH}=0,15\left(mol\right)\Rightarrow CM_{RCOOH}=\frac{0,15}{0,2}=9,75M\)
\(n_{RCOOH}=n_{NaOH}=0,15\left(mol\right)\)
\(\Rightarrow R_{RCOOH}=\frac{12,3}{0,15}=82\Rightarrow R=15\left(CH_3\right)\)
Vậy axit là CH3COOH

- Đáp án C
- Từ [OH-]= 1,5.10-5 (M) suy ra:
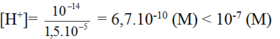
Vậy môi trường của dung dịch là kiềm.

nOH-=0,5.2.0,2=0,2 mol
mHCL=200.1,05=210g=> mHCL=210.10/100=21g
n H+=nHCL=21/36,5=0,57 mol =>nH+>nOH-=>dd thu được có tính axit
nBa(OH)2 = 0.2*0.5=0.1 mol
mddHCl= V*d=200*1.05=210g
=> mHCl =210*10/100=21g
=> nHCl =21/36.5=\(\dfrac{42}{73}\) \(\approx\) 0.575mol
PTHH: 2HCl + Ba(OH)2 ----> BaCl2 + H2O
\(\dfrac{42}{73}\) 0.1
Ta thấy HCl dư \(\dfrac{137}{730}\) mol
Vậy dd thu được vẫn còn axit.

Môi trường bazơ do KOH tan trong nước phân ly ra ion \(OH^-\) có tính bazơ
\(KOH\rightarrow K^++OH^-\)
Chọn D