Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Môi trường bazơ do KOH tan trong nước phân ly ra ion \(OH^-\) có tính bazơ
\(KOH\rightarrow K^++OH^-\)
Chọn D

\(n_{NaOH}=\dfrac{8}{40}=0,2mol\)
\(n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\)\(mol\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
0,2 0,2
Dung dịch thu được là \(Na_2SO_4\) có môi trường trung hòa.

Gọi công thức của axit RCOOH
Ta có:
\(n_{NaOH}=0,3.0,5=0,15\left(mol\right)\)
\(PTHH:RCOOH+NaOH\rightarrow RCOONa+H_2O\)
____________0,15______0,15____________
\(\Rightarrow n_{RCOOH}=0,15\left(mol\right)\Rightarrow CM_{RCOOH}=\frac{0,15}{0,2}=9,75M\)
\(n_{RCOOH}=n_{NaOH}=0,15\left(mol\right)\)
\(\Rightarrow R_{RCOOH}=\frac{12,3}{0,15}=82\Rightarrow R=15\left(CH_3\right)\)
Vậy axit là CH3COOH

- Đáp án C
- Từ [OH-]= 1,5.10-5 (M) suy ra:
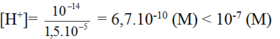
Vậy môi trường của dung dịch là kiềm.

nOH-=0,5.2.0,2=0,2 mol
mHCL=200.1,05=210g=> mHCL=210.10/100=21g
n H+=nHCL=21/36,5=0,57 mol =>nH+>nOH-=>dd thu được có tính axit
nBa(OH)2 = 0.2*0.5=0.1 mol
mddHCl= V*d=200*1.05=210g
=> mHCl =210*10/100=21g
=> nHCl =21/36.5=\(\dfrac{42}{73}\) \(\approx\) 0.575mol
PTHH: 2HCl + Ba(OH)2 ----> BaCl2 + H2O
\(\dfrac{42}{73}\) 0.1
Ta thấy HCl dư \(\dfrac{137}{730}\) mol
Vậy dd thu được vẫn còn axit.

Có [OH-] = 10-5
=> pH = 14 - 5 = 9 > 7
=> Môi trường dung dịch là kiềm
=>D

Số mol HCl = 0,08 mol => Số mol nước tạo thành sau pư = 0,08 mol.
BTKL: mmuối = 3,4 + 80. 3,65% - 0,08.18 = 4,88g
Đáp án: B