Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B

Như vậy khi tăng nhiệt độ thì cân bằng chuyển dịch theo chiều làm tăng số mol khí, tức là chiều nghịch.
Mặt khác, theo nguyên lí chuyển dịch cân bằng : Khi tăng nhiệt độ thì cân bằng chuyển dịch theo chiều phản ứng thu nhiệt
->Phản ứng thuận toả nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ

Chọn D
Khi giảm áp suất, cân bằng sẽ chuyển dịch theo chiều làm tăng áp suất của hệ, tức là chiều làm tăng số phân tử khí. Vậy trong 4 cân bằng trên, có 1 cân bằng chuyển dịch theo chiều nghịch khi giảm áp suất cân bằng là (IV).

Ở 100°C là nhiệt độ cao bắt buộc ra KClO3
nCl2=0,6 mol
nKCl=0,5 mol
3Cl2 +6KOH =>5KCl + KClO3 +3H2O
0,6 mol
0,3 mol <=0,6 mol 0,5 mol
Dư 0,3 mol
CM dd KOH=0,6/2,5=0,24M
=>Chon A!!!!

Chọn B
(3) sai vì cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ của phản ứng nghịch. Đối với phản ứng thuận nghịch thì hiệu suất phản ứng luôn nhỏ hơn 100%.
(5) sai vì khi phản ứng thuận nghịch đạt tới trạng thái cân bằng thì phản ứng thuận và nghịch vẫn diễn ra với tốc độ như nhau, nên nồng độ các chất trong dung dịch không thay đổi theo thời gian.

Chọn B
Nguyên lý chuyển dịch cân bằng : Khi tác động các yếu tố từ bên ngoài như nồng độ, nhiệt độ, áp suất vào một hệ cân bằng thì cân bằng sẽ chuyển dịch theo chiều chống lại sự tác động đó. Suy ra :
+ Khi tăng nhiệt độ, cân bằng sẽ chuyển dịch theo chiều phản ứng thu nhiệt và ngược lại.
+ Khi tăng nồng độ của một chất, cân bằng sẽ chuyển dịch theo chiều làm giảm nồng độ của chất đó và ngược lại.
+ Khi tăng áp suất, cân bằng sẽ chuyển dịch theo chiều làm giảm áp suất, tức là chiều làm giảm số phân tử khí và ngược lại.
Theo giả thiết, ta thấy phản ứng thuận là phản ứng thu nhiệt, nên khi tăng nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều thuận.
Thêm PCl3 hoặc Cl2 vào hệ phản ứng thì cân bằng sẽ chuyển dịch theo chiều nghịch.
Tăng áp suất thì cân bằng sẽ chuyển dịch theo chiều nghịch

MX=6,25.16 =100
X là este đơn chức chỉ chứa C,H,O nên ta tìm được công thức phân tử là C5H8O2
Xét pư thủy phân 0,2mol X trong 0,3mol KOH
Vì X đơn chức nên pư xảy ra với tỷ lệ 1:1 suy ra KOH dư
Bảo toàn khối lượng ta có mX+mKOH=mrắn khan+mchất bay hơi Y
Suy ra mchất bay hơi Y=20+0,3.56-28=8,8(g)
mà nY=nX=0,2 mol
Vậy MX=8,8/0,2=44 \(\Rightarrow\) X có công thức phân tử C2H4O
Chỉ có đáp án B thỏa mãn

2 ancol đơn chức chứ bạn đáp án toàn ancol đơn chức =))
nCO2=0,4 mol nH2O=0,4 mol=>nCO2=nH2O
=>hh gồm các ete no đơn chức
Gọi CTTQ ete là CnH2nO
Bảo toàn klg=>mO2=0,4.44+7,2-7,2=17,6g=>nO2=0,55 mol
Bảo toàn O=>nete=nO trg ete=0,4.2+0,4-0,55.2=0,1 mol
=>Mete=72 g/mol
=>CTPT ete là C4H8O
Chỉ có 1 ctct tm CH2=CH-CH2-O-CH3
=>ete này đc tạo bởi 2 ancol CH3OH và CH2=CH-CH2OH
=>chọn D
Ete + O2 \(\rightarrow\)CO2 + Hoh
số mol ete là x
nCO2 = nhoh = 0.4 \(\rightarrow\) m = \(0,4.\left(18+44\right)=24,8\)
Dựa vào bảo toàn khối lượng: mO2 = 24,8 -7.2 = 17,6\(\rightarrow\) nO2 = 0,55
Bảo toàn nguyên tố oxi: x + 0,55 .2 = 0,4.3\(\rightarrow\) x = 0.1
Mete = 7,2/ 0.1 =72\(\rightarrow\) CH3 - O - C3H5
Đáp án D

Đáp án D
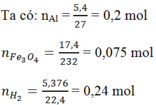

Gọi số mol Fe3O4 phản ứng là x mol
Vì hiệu suất không đạt 100% nên cả Al và Fe3O4 đều chưa phản ứng hết.
⇒Hỗn hợp rắn sau phản ứng gồm Al dư, Fe3O4 dư, Al2O3 và Fe.
Theo phản ứng: nAl phản ứng = 8/3 x mol ⇒ nAl dư = (0,2 – 8/3 x) mol

![]()
![]()
![]()
Chọn B
Theo giả thiết : Khi tăng nhiệt độ của hệ thì tỉ khối của hỗn hợp so với H2 giảm. Suy ra khối lượng trung bình của hỗn hợp giảm. Mặt khác, khối lượng hỗn hợp không thay đổi. Suy ra số mol khí tăng lên, tức là cân bằng đã chuyển dịch theo chiều thuận.
Vậy nhận xét đúng là : "Khi tăng nhiệt độ của hệ, cân bằng chuyển dịch theo chiều thuận".