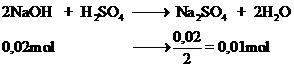Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1/
a)
\(n_{Ba}=\frac{27,4}{137}=0,2mol\); \(n_{H_2SO_4}=\frac{9,8}{98}=0,1mol\)
PTHH: \(Ba+H_2SO_4\rightarrow BaSO_4\downarrow+H_2\uparrow\)
Trước pư: \(0,2\) \(0,1\) \(\left(mol\right)\)
Pư: \(0,1\) \(0,1\) \(0,1\) \(0,1\) \(\left(mol\right)\)
Sau pư: \(0,1\) \(0\) \(0,1\) \(0,1\) \(\left(mol\right)\)
Sau pư còn dư 0,1mol Ba nên Ba tiếp tục pư với H2O trong dd:
\(Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\uparrow\)
\(0,1\) \(0,1\) \(0,1\) \(\left(mol\right)\)
Tổng số mol H2 sau 2 pư : \(n_{H_2}=0,1+0,1=0,2mol\)
Thể tích khí thu được: \(V_{H_2}=0,2.22,4=4,48l\)
b)
Dd thu được sau pư là dd \(Ba\left(OH\right)_2\)
\(m_{Ba\left(OH\right)_2}=0,1.171=17,1g\)
\(m_{dd}=27,4+100-m_{BaSO_4}-m_{H_2}\)\(=27,4+100-0,1.233-0,2.2=103,7g\)
\(C\%_{ddBa\left(OH\right)_2}=\frac{17,1}{103,7}.100\%\approx16,49\%\)
2/
\(n_{H_2S}=\frac{0,672}{22,4}=0,03mol\)
\(CaS+2HBr\rightarrow CaBr_2+H_2S\uparrow\)
Theo pt:
\(n_{CaS}=n_{CaBr_2}=n_{H_2S}=0,03mol\) ; \(n_{HBr}=0,06mol;\)\(m_{HBr}=0,06.81=4,86g\)
\(m=m_{CaS}=0,03.72=2,16g;\)\(m_{CaBr_2}=0,03.200=6g\)
\(\Rightarrow m_1=\frac{4,86.100}{9,72}=50g\)
Áp dụng ĐLBTKL:
\(m_2=m_{ddCaBr_2}=50+2,16-34.0,03=51,14g\)
\(x=C\%_{CaBr_2}=\frac{6.100}{51,14}\approx11,73\%\)

Bài 1
PTHH : NaOH + HCl -> NaCl + H2O
a, mdung dịch = 200 + 100 = 300 (g)
C%HCl= 100/300 .100% =33,33%
b, mNaOH=200.20%=40(g)
=> nNaOH =1(mol)
Theo PTHH , nNaCl = nNaOH = 1(mol)
=> mNaCl=58,5 (g)
=> C% = 58,5/300 . 100% = 19,5%
Bài 2
PTHH : Mg + H2SO4 -> MgSO4 + H2
mH2SO4=29,4(g)=> nH2SO4 = 29,4/98=0,3(mol)
mMg= 2,4/24=0,1 (mol)
Vì ),1<0,3=> Mg phản ứng hết , tính theo số mol Mg
Theo PTHH , nH2=nMg = 0,1 (mol)=>VH2(dktc) = 2,24 (l)
b, Theo PTHH , nH2SO4= 0,1 (mol)=> nH2SO4 dư = 0,2 (mol)=> mH2SO4 dư = 0,2 .98 = 19,6 (g)
Theo PTHH , nMgSO4 = 0,1 (mol)=> mMgSO4 = 0,1 . (24+32+16.4)=12(g)
=> mdung_dịch _ sau _Phản _ứng= 12+19,6 =31,6 (g)
C%MgSO4= 12/31,6 . 100% \(\approx38\%\)
C%H2SO4 dư = 62%

a) Trích mẫu thử, đánh số thứ tự
_Cho lần lượt các khí trên thử với que đóm còn tàn đỏ. Khí nào làm que đóm còn tàn đỏ bùng cháy thì khí đó là O2
_Cho 3 khí còn lại lần lượt lội qua dd Ca(OH)2. Sau pư, chất khí nào làm vẩn đục dd Ca(OH)2 thì khí đó là CO2
_ Cho 2 khí còn lại đun nóng với CuO. Sau pư khí nào làm chất rắn chuyển thành đỏ thì khí đó là H2
_ Chất còn lại là N2
PT: CO2 + Ca(OH)2 ---> CaCO3 + H2O
H2 + CuO ---> Cu + H2O
b) Trích mẫu thử, đánh số thứ tự
_ Cho các chất này vào nước. Sau pư ta thấy có 2 chất tan đó là Na và Na2O (nhóm I) và 2 chất không tan (nhóm II)
_ Nhóm I khi tác dụng với nước, nếu sau pư, lọ nào có chất khí bay lên thì lọ đó chứa Na, lọ còn lại là Na2O
_ Nhóm II cho tác dụng với dd HCl, sau pư, lọ nào có chất khí bay lên thì lọ đó chứa Mg, lọ còn lại là MgO
PT:
2Na + 2H2O ---> 2NaOH + H2
Na2O + H2O ---> 2NaOH
Mg + 2HCl ---> MgCl2 + H2
MgO + 2HCl ---> MgCl2 + H2O
c) Trích mẫu thử, đánh số thứ tự
_Cho cả ba chất vào nước, chất nào ít tan thì chất đó là CaO
_Cho 2 dd còn lại sau khi đã cho vào nước thử với quỳ tím, lọ nào làm quỳ tím hóa đỏ thì lọ đó chứa P2O5, lọ nào làm quỳ tím hóa xanh thì lọ đó chứa Na2O
PT:
P2O5 + 3H2O ---> 2H3PO4
Na2O + H2O ---> 2NaOH
d) Trích mẫu thử, đánh số thứ tự
_ Cho quỳ tím thử với các dd, lọ nào làm quỳ tím hóa đỏ thì lọ đó chứa HCl, lọ nào làm quỳ tím hóa xanh thì lọ đó chứa NaOH.
_ 2 dd còn lại, ta cô cạn chúng, sau khi cô cạn, lọ nào còn chất rắn thì lọ đó chứa NaCl, lọ còn lại chứa H2O

1. Trong 4 kim loại trên, không có kim loại nào tác dụng được với cả 4 dung dịch trên.
2. Chúng ta có thể dùng nước vôi trong để loại bỏ các khí độc trên là tốt nhất.
PTHH: Ca(OH)2 + 2H2S ===> 2H2O + Ca(HS)2
Ca(OH)2 + CO2 ===> CaCO3 + H2O
Ca(OH)2 + SO2 ===> CaSO3 + H2O
2Ca(OH)2 + 2Cl2 ===> CaCl2 + Ca(ClO)2 + 2H2O
3. Các cặp dung dịch không tác dụng được với nhau là:
+) Dung dịch HNO3 và dung dịch BaCl2
4. Những cặp chất sau đây tác dụng được với nhau là:
+) Al và dung dịch KOH

Gọi kim loại hóa trị II là A, kim loại hóa trị III là B
A + 2HCl => ACl2 + H2
2B + 6HCl => 2BCl3 + 3H2
nHCl = 0.17 x 2 = 0.34 (mol)
==> mHCl = n.M = 36.5 x 0.34 = 12.41 (g)
Theo phương trình ==> nH2 = 0.17 (mol) ==> VH2 =22.4 x 0.17 = 3.808 (l)
m muối = mHCl + mA + mB - mH2 = 12.41 + 4 - 0.17 x 2 = 16.07 (g)
H2 + CuO => Cu + H2O
Fe2O3 + 3H2 => 2Fe + 3H2O
mhh = n.M = 0.17 x 120 = 20.4 (g)
Mg + H2SO4 => MgSO4 + H2
Fe + H2SO4 => FeSO4 + H2
Zn + H2SO4 => ZnSO4 + H2
Gọi x,y,z (mol) lần lượt là số mol của Mg,Fe,Zn
nH2 = V/22.4 = 1.344/22.4 = 0.06 (mol)
nH2SO4 = 0.2 x 1 = 0.2 (mol)
Theo phương trình nH2SO4 = nH2 (mà 0.2 = 0.06) ===> vô lý
Xem lại đề???

m Mg = 4,8 g => n Mg = 0,2 mol
Mg + H2SO4 -> MgSO4 + H2
0,2 0,2 0,2
=> m H2SO4 = 0,2 . 98 = 19,6g
=> m dd H2SO4 = \(\frac{19,6.100\%}{24,5\%}=80g\)
m dd sau pứ = m dd H2SO4 = 80g
=> C% dd muối = \(\frac{0,2.120.100\%}{80}\)= 30%
#mã mã#

2) Kẽm + dd Axit clohidric ---> kẽm clorua + khí hidro
Zn + 2HCl ---> ZnCl2 + H2
BTKL: mZn + 6 = 13 + 7 ---> mZn = 14 g
1 , a , Axit sunfuric + natri hidroxit -> natri sunfat + nước

nồng dộ của dung dịch H2SO4 và NaOH là a và b,ta có
H2SO4 + 2NaOH = Nà2SO4 + 2H2O
0,02a--------0,04a
=>0,04a=0,06b
H2SO4+2NaOH=Na2SO4+2H2O
0,01b/2---0,01b
H2SO4+BaCO3=BaSO4+H2O+CO2
0,03--------0,03
=>0,02a-0,01b/2=5,91/197=0,03
=>a=1,8 và b=1,2