Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Fr là kim loại mạnh nhất. F là phi kim mạnh nhất.
b) Các kim loại được phâ bố ở khu vực bên trái trong bảng tuần hoàn.
c) Các phi kim được phân bố ở khu vực bên phải trong bảng tuần hoàn.
d) Nhóm IA gồm những kim loại mạnh nhất. Nhóm VIIA gồm những phi kim mạnh nhất.
e) Các khí hiếm nằm ở nhóm VIIIA ở khu vực bên phải trong bảng tuần hoàn.

Trong một chu kì thì nguyên tử các nguyên tố có cùng số lớp electron theo chiều điện tích hạt nhân tăng dần, bán kính nguyên tử giảm dần, nên khả năng dễ mất electron ở lớp ngoài cùng giảm dần nên tính kim loại giảm dần, đồng thời khả năng thu thêm electron ở lớp ngoài cùng tăng dần nên tính phi kim tăng dần

Nhóm A:
- Số thứ tự của nhóm trùng với số electron ở lớp ngoài cùng (cũng đồng thời là số electron hóa trị) của nguyên tử thuộc các nguyên tố trong nhóm.
- Nhóm A có cả nguyên tố thuộc chu kì nhỏ và chu kì lớn.
- Các nguyên tố ở nhóm IA, IIA được gọi là nguyên tố s. Các nguyên tố ở nhóm IIA đến VIIIA được gọi là nguyên tố p. Trong bảng tuần hoàn, nhóm IA, IIA, IIIA gồm hầu hết các nguyên tố là kim loại, nhóm VA, VIA, VIIA gồm hầu hết các nguyên tố là phi kim. Nhóm VIIIA gồm các khí hiếm.
- Số electron lớp ngoài cùng của nguyên tử thuộc nguyên tố nằm trong từng nhóm A trùng với số thứ tự của nhóm.

Nhóm A:
- Số thứ tự của nhóm trùng với số electron ở lớp ngoài cùng (cũng đồng thời là số electron hóa trị) của nguyên tử thuộc các nguyên tố trong nhóm.
- Nhóm A có cả nguyên tố thuộc chu kì nhỏ và chu kì lớn.
- Các nguyên tố ở nhóm IA, IIA được gọi là nguyên tố s. Các nguyên tố ở nhóm IIA đến VIIIA được gọi là nguyên tố p. Trong bảng tuần hoàn, nhóm IA, IIA, IIIA gồm hầu hết các nguyên tố là kim loại, nhóm VA, VIA, VIIA gồm hầu hết các nguyên tố là phi kim. Nhóm VIIIA gồm các khí hiếm.
- Số electron lớp ngoài cùng của nguyên tử thuộc nguyên tố nằm trong từng nhóm A trùng với số thứ tự của nhóm.

Hạt nhân nguyên tử cho biết số proton (nghĩa là cho biết số đơn vị điện tích hạt nhân) nên theo yêu cầu của đề bài ta có thế viết cấu hình electron của nguyên tử các cặp nguyên tố như sau :
a) z = 1 : ls1 ; z = 3 : ls2 2S1 ;
b) z = 8 : ls2 2s2 2p4 ; z = 16 : ls2 2s2 2p6 3s2 3p4 ;
c) z = 7 : ls2 2s2 2p3 ; z = 9 : ls2 2s2 2p5.
Nguyên tố kim loại có 1, 2, 3 electron lớp ngoài cùng, nên nguyên tố có z = 3 là kim loại, còn nguyên tố z = 1 là H giống kim loại nhưng không phải là kim loại.
Nguyên tố phi kim có 5, 6, 7 electron ở lớp ngoài cùng nên các nguyên tô có z = 8, z = 16, z = 7, z = 9 là phi kim.

F O Cl N
Độ âm điện: 3,98 3,44 3,16 3,14
Nhận xét: tính phi kim giảm dần.
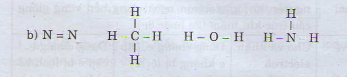
N2 CH4 H2O NH3
Hiệu độ âm điện: 0 0,35 1,24 0,84
Phân tử N2, CH4 có liên kết cộng hóa trị không phân cực. Phân tử H2O có liên kết cộng hóa trị phân cực mạnh nhất trong dãy.

Giả sử: M số proton và nơtron lần lượt là p và n
=> Khối lượng nguyên tử của M: mp.p+mn.n
X có số p và n lần lượt là p và n
=> Khối lượng nguyên tử của X là: mp.p +mn.n
( mp và mn lần lượt là khối lượng của 1 hạt proton và 1 hạt nơtron)
Mà mp =mn = 1,67.10^-27 nên
Khối lượng nguyên tử của M: mp.( n+p)
Khối lượng nguyên tử của X : mp.(n + p )
(+++: Vì khối lượng của 1 nguyên tử là tổng khối lượng của p, e và n, mà khối lượng của e không đáng kể nên khối lượng của nguyên tử có thể tính bằng khối lượng của p và n)
* ta có:
n-p = 4 <=> n=p+4 (1)
n =p (2)
p+ xp = 58 => xp = 58 - p (3)
* Hợp chất A có công thức MX(x) trong đó M chiếm 46,67% về khối lượng nên:
M / (M+xX) = 46,67/100 <=> [mp.(n+p)] / [mp.(n+p) + x.mp.(n +p )] = 46,67/100
<=> (n+p) / [(n+p) +x(n +p )] = 46,67/100 (4)
Thay (1), (2), (3) vào (4) ta giải ra được : p = 26 => Kim loại M chính là Fe
p=26 => n= 26 +4 = 30 và xp = 32
Với x=1 => p =32 => phi kim là Ge (loại )
Với x=2 => p =16 => phi kim là S( thuộc chu kì 3 nên thỏa mãn điều kiên=> chọn)
Vậy công thức của hợp chất A là: FeS2

Bài này tương tự, tham khảo.
Hỗn hợp A gồm oxit của một kim loại hoá trị II và muối cacbonat của kim loại đó được hoà tan hết bằng axit HCl vừa đủ tạo ra khí B và còn dung dịch D. Đem cô cạn D thu được một lượng muối khan bằng 168% lượng A. Biết khối lượng khí B bằng 44% lượng A. Hỏi kim loại hoá trị II nói trên là nguyên tố nào ? % lượng mỗi chất trong A bằng bao nhiêu.
Bài làm
Gọi kim loại hóa trị II là R, có nguyên tử khối là R (R > 0), x là số mol của RO (x > 0)
Theo bài ra ta có các PTHH :
RO + H2SO4 \(\rightarrow\) RSO4 + H2O
RCO3 + H2SO4 \(\rightarrow\) RSO4 + CO2\(\uparrow\) + H2O
Giả sử khối lượng của A đem tham gia p.ứng là 100g thì khối lượng RSO4 = 168g và khối lượng CO2 = 44g \(\approx\) 1 mol.
Theo giả sử ta có : (R + 16)x + R + 60 = 100 (1)
Theo phương trình ta có : (R + 96)x + R + 96 = 168 (2)
Từ (1), (2) \(\Rightarrow\) x = 0,4
R \(\approx\) 24 \(\Rightarrow\) Mg
Phần trăm khối lượng của oxit là : %MgO = 16%
Phần trăm khối lượng của muối là : %MgCO3 = 84%
chép mạng . Không tính. Mới có lớp 7 làm sao nổi hóa lớp 8 chứ không ns đến lớp 10
Đáp án: C
Cấu hình electron của X, Y lần lượt là
13X: 1s22s22p63s23p1
17Y: 1s22s22p63s23p5
- X có 3 electron hóa trị, electron cuối cùng điền vào phân lớp 3p → X có xu hướng nhường 3 electron để đạt được cấu hình của khí hiếm → X là nguyên tố kim loại.
- Y có 7 electron hóa trị, electron cuối cùng điền vào phân lớp 3p → Y có xu hướng nhận 1 electron để đạt được cấu hình của khí hiếm → Y là nguyên tố phi kim.