Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\Delta_rH^o_{298}=2\left(-825,5\right)+8\left(-296,8\right)-4\left(-177,9\right)\\ \Delta_rH^o_{298}=-3313,8\left(kJ\right)\)

6nCO2(g) + 6nH2O(l) → (C6H12O6)n(s) + 6nO2(g)
∆fH0298 = ∆fH0298 (C6H12O6) + 6 x ∆fH0298 (O2) - 6 x ∆fH0298 (CO2) - 6 x ∆fH0298 (H2O)
= -1271,1 + 6 x 0 – 6 x -393,5 – 6 x -285,8 = 2804,7 kJ.mol-1
=> Phải cung cấp 2804,7 kJ dưới dạng ánh sáng cho phản ứng quang hợp để tạo thành 1 mol glucose C6H12O6(s)

\(C_2H_6+\dfrac{7}{2}O_2->2CO_2+3H_2O\\ \Delta_rH^o_{298}=2\left(-393,5\right)+3\left(-285,8\right)-\left(-84,7\right)\\ \Delta_rH^o_{298}=-1559,7kJ\)
Phương trình nhiệt hoá học thì không cần ghi điều kiện nhé.

\(\Delta_rH^{^{ }o}_{298}=3\cdot436+945-2\left(3\cdot386\right)=-63kJ\cdot mol^{-1}\)
Sơ đồ:


\(N_2O_4+3CO->N_2O+3CO_2\\ \Delta_rH^o_{298}=82,05+3\left(-393,50\right)-\left(9,16+3\left(-110,50\right)\right)\\ \Delta_rH^o_{298}=-776,11kJ\)

\(\Delta_rH^o_{298}=436+243-2\cdot432\\ \Delta_rH^o_{298}=-185kJ\cdot mol^{-1}\)
Để tính biến thiên enthalpy chuẩn của phản ứng, ta có thể sử dụng công thức sau:
ΔH° = (tổng năng lượng liên kết sản phẩm) - (tổng năng lượng liên kết phản ứng chất). Trong trường hợp này, ta có: Tổng năng lượng liên kết phản ứng chất = Eb(H-H) + Eb(Cl-Cl) = 436 + 243 = 679 kJ/mol Tổng năng lượng liên kết sản phẩm = 2Eb(H-Cl) = 2 * 432 = 864 kJ/mol Vậy biến thiên enthalpy chuẩn của phản ứng là: ΔH° = 864 - 679 = 185 kJ/mol.

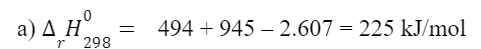
b) Trong N2, liên kết giữa 2 nguyên tử là liên kết ba – một loại liên kết bển, cần 1 năng lượng rất lớn để phá vỡ liên kết đó.
=> N2 khá trơ về mặt hóa học và chỉ phản ứng với oxy khi có nhiệt đô cao hoặc có tia lửa điện


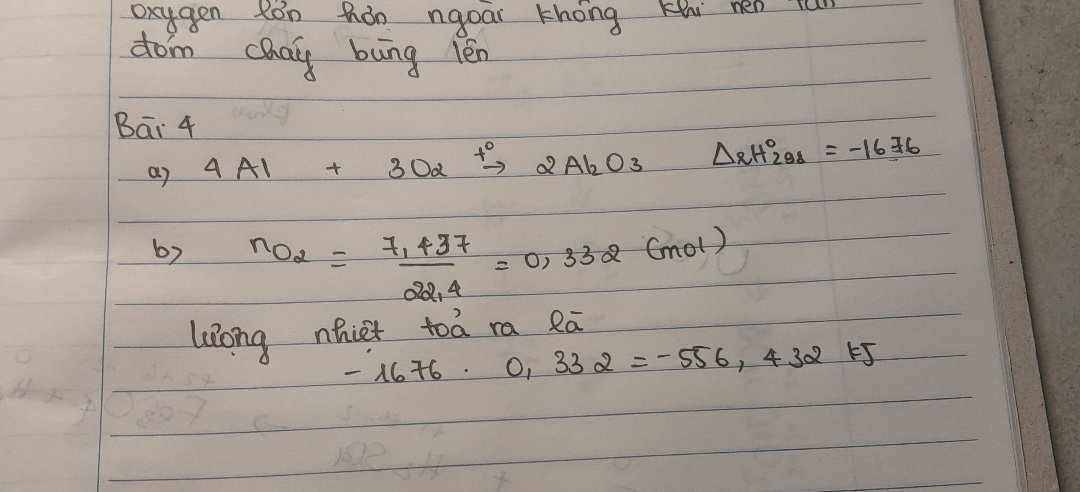
A. Sai vì đó là nhiệt tạo thành của 2 mol HCl
B. Đúng vì (*) là phản ứng tỏa nhiệt nên enthalpy mang giá trị âm
C. Đúng vì nhiệt tạo thành tỉ lệ với số mol chất tạo thành, đây là phản ứng tỏa nhiệt nên mang giá trị âm
D. Sai vì phản ứng (*) ứng với 2 mol
=> Đáp án B, C đúng