Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi X là Kl h.trị II
XCO3 + H2SO4 \(\rightarrow\) XSO4 + CO2 + H2O
\(\rightarrow\) nXCO3=nXSO4
\(\Leftrightarrow\) \(\frac{2,1}{X+60}=\frac{3}{X+96}\)
\(\rightarrow\)X=24 (Mg)
\(\rightarrow\)CT muối Cacbonat là MgCo3

Gọi M là kí hiệu nguyên tử khối của kim loại hoá trị I. Công thức muối là M 2 CO 3 . Phương trình hoá học của phản ứng :
M 2 CO 3 + 2HCl → 2 MCl 2 + H 2 O + CO 2
(2M + 60)g 22400ml
1,06g 224ml
Theo phương trình hóa học trên ta có:
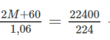
→ M = 23. Đó là muối Na 2 CO 3

Hoà tan hoàn toàn m gam oxit MO M là kim loại trong 78 4 gam dung dịch H2SO4 6 25 loãng thì thu được dung dịch E trong đó nồng độ H2SO4 còn d
Tại đây

Hỗn hợp khí thu được gồm H2 và CO2 có tổng mol = 6,72/22,4= 0,3 mol
----> nCO2 < 0,3 mol
hỗn hợp khí cho vào NaOH chỉ có CO2 phản ứng
nNaOH/nCO2 > 1 (vì nCO2 < 0,3) --> dung dịch B có 2 khả năng:
TH1: B gồm 2 muối NaHCO3 và Na2CO3 ; NaOH hết
Gọi nNa2CO3=x ; nNaHCO3 = 0,3-2x
-> m=106x + (0,3-2x).84= 14,6 --> x=0,171 ( loại vì nNa2CO3 = 0,171.2=0,342 > nNaOH)
TH2. B gồm Na2CO3 và NaOH dư
Gọi nCO2= x --> nNa2CO3=x -> nNaOH= 0,3-2x
m=106x + (0,3-2x).40 = 14,6
--> x= 0,1 mol ---> nCO2=0,1 mol ; nH2= 0,2 mol
--> nMg= 0,2 ; nMgCO3 = 0,1
--> m=0,2.24 + 0,1.84= 13,2 g

a)
$RCO_3 + H_2SO_4 \to RSO_4 + CO_2 + H_2O$
Theo PTHH :
$n_{RCO_3} = n_{RSO_4}$
Suy ra : \(\dfrac{12,4}{R+60}=\dfrac{16}{R+96}\)
Suy ra : R = 64(Cu)
Vậy muối là $CuCO_3$
b)
$n_{CO_2} = n_{H_2SO_4} = n_{CuSO_4} = 16 : 160 = 0,1(mol)$
$m_{dd\ H_2SO_4} = \dfrac{0,1.98}{9,8\%} = 100(gam)$
$m_{dd\ sau\ pư} = 12,4 + 100 -0,1.44 = 108(gam)$
$C\%_{CuSO_4} = \dfrac{16}{108}.100\% = 14,81\%$


M2(CO3)x+ 2xHCl→ 2MClx+ xCO2+ xH2O
a __________________2a
Ta có:
\(\text{2a. 35,5x- a.60x= 10,7-9,6}\)
\(\text{⇒ ax= 0,1}\)
Nên:
0,1.60+ 2M.\(\frac{0,1}{x}\)= 9,6
⇒ x=3; M=27
CT: Al2(CO3)3