Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nH2= 0,35(mol)
a) PTHH: Mg + 2 HCl -> MgCl2 + H2
x_________2x_______x______x(mol)
PTHH: Fe + 2 HCl -> FeCl2 + H2
y________2y________y_____y(mol)
Ta có hpt: \(\left\{{}\begin{matrix}24x+56y=13,2\\x+y=0,35\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,15\end{matrix}\right.\)
b) m=m(muối khan)= mMgCl2 + mFeCl2= 95.x+127y=95.0,2+127.0,15= 38,05(g)
a)
Gọi
\(n_{Fe} = a(mol) ; n_{Mg} = b(mol)\\ \Rightarrow 56a + 24b = 13,2(1)\)
\(Mg + 2HCl \to MgCl_2 + H_2\\ Fe + 2HCl \to FeCl_2 + H_2\)
Theo PTHH : \(n_{H_2} = a + b = 0,35(mol)\)(2)
Từ (1)(2) suy ra a = 0,15 ;b = 0,2
Vậy :
\(\%m_{Fe} = \dfrac{0,15.56}{13,2}.100\% = 63,64\%\\ \Rightarrow m_{Mg} = 100\% - 63,64\% = 36,36\%\)
b)
Ta có :\(n_{HCl} = 2n_{H_2} = 0,7(mol)\)
Bảo toàn khối lượng :
\(m_{muối} = m_{kim\ loại} + m_{HCl} - m_{H_2} = 13,2 + 0,7.36,5 - 0,35.2=38,05(gam)\)

Sửa đề: đktc → đkc
a, \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: 24nMg + 56nFe = 13,2 (1)
\(n_{H_2}=\dfrac{8,6765}{24,79}=0,35\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Mg}+n_{Fe}=0,35\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,2\left(mol\right)\\n_{Fe}=0,15\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,2.24}{13,2}.100\%\approx36,36\%\\\%m_{Fe}\approx63,64\%\end{matrix}\right.\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{MgCl_2}=n_{Mg}=0,2\left(mol\right)\\n_{FeCl_2}=n_{Fe}=0,15\left(mol\right)\end{matrix}\right.\)
⇒ m muối khan = 0,2.95 + 0,15.127 = 38,05 (g)

1)2Al+6HCl ->2Al2Cl3+3H2
Fe+2HCl->FeCl2+H2
Gọi số mol của Al là x;Fe là y
ta có 2x*23+56y=8.3
3x+y=5.6/22.4
giải ra là xong hết bài 1 r nha

a)Gọi x,y lần lượt là số mol của Al, Fe trong hỗn hợp ban đầu (x,y>0)
Sau phản ứng hỗn hợp muối khan gồm: \(\left\{{}\begin{matrix}AlCl_3:x\left(mol\right)\\FeCl_2:y\left(mol\right)\end{matrix}\right.\)
Ta có hệ phương trình: \(\left\{{}\begin{matrix}27x+56y=13,9\\133,5x+127y=38\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x\approx0,0896\\y\approx0,205\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,0896\cdot27\cdot100\%}{13,9}\approx17,4\%\\\%m_{Fe}=\dfrac{0,205\cdot56\cdot100\%}{13,9}\approx82,6\%\end{matrix}\right.\)
Theo Bảo toàn nguyên tố Cl, H ta có:\(n_{H_2}=\dfrac{n_{HCl}}{2}=\dfrac{3n_{AlCl_3}+2n_{FeCl_2}}{2}\\ =\dfrac{3\cdot0,0896+2\cdot0,205}{2}=0,3394mol\\ \Rightarrow V_{H_2}=0,3394\cdot22,4\approx7,6l\)

Câu 1:
Đặt \(n_{Fe}=x\left(mol\right);n_{Al}=y\left(mol\right)\)
\(n_{HCl}=0,4\left(mol\right)\)
\(Fe^o\rightarrow Fe^{+2}+2e\)
x_____________2x_(mol)
\(Al^o\rightarrow Al^{+3}+3e\)
y____________3y_(mol)
\(2H^-\rightarrow H_2^o+2e\)
0,8_____0,4____0,8_(mol)
\(BTe:2x+3y=0,8\)
Theo đề ta có hệ: \(\left\{{}\begin{matrix}56x+27y=11\\2x+3y=0,8\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{Fe}=\frac{0,1.56}{11}.100\%=51\left(\%\right)\\\%m_{Al}=100-51=49\left(\%\right)\end{matrix}\right.\)
\(BTNT:\Rightarrow\left\{{}\begin{matrix}n_{FeCl_2}=0,1\left(mol\right)\\n_{AlCl_3}=0,2\left(mol\right)\end{matrix}\right.\)
\(m_{hh}=0,1.127+133,5.0,2=39,4\left(g\right)\)
\(m_{ddHCl}=\frac{36,5.0,8.100}{7,3}=400\left(g\right)\)
Câu 2:
\(n_{H_2}=0,15\left(mol\right)\)
\(PTHH:2Al+6HCl\rightarrow2AlCl_3+3H_2\)
(mol)____0,1____0,3______0,1______0,15__
\(\%m_{Al_2O_3}=\frac{7,8-27.0,1}{7,8}.100\%=65,4\left(\%\right)\)
Câu 3:
\(n_{H_2}=0,1\left(mol\right)\)
\(PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\)
(mol)_____0,1__________________0,1__
\(\%m_{ZnO}=\frac{10,55-0,1.65}{10,55}.100\%=38,4\left(\%\right)\)

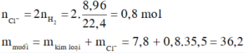
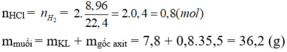
* Tính khối lượng muối sinh ra.
PT phản ứng : \(\begin{cases}Al\\Mg\end{cases}\) \(+\) \(HCl\) \(\rightarrow\) \(\begin{cases}AlCl_3\\MgCl_2\end{cases}\) \(+\) \(H_2\)
nH2 = 8,96/22,4 = 0,4 (mol)
Ta có : nHCl = 2nH2 = 0,8 (mol)
Áp dụng định luật BTKL , ta có :
mmuối = mhỗn hợp + mHCl - mH2 = 7,8 + 0,8.36,5 - 0,4.2 = 36,2 (g)
* Tính khối lượng kim loại trong hỗn hợp :
Gọi x và y lần lượt là số mol của Al và Mg . Ta có
PTHH :
2Al + 6HCl -----> 2AlCl3 + 3H2
x 3x/2
Mg + 2HCl -----> MgCl2 + H2
y y
Ta có hệ \(\begin{cases}27x+24y=7,8\\\frac{3x}{2}+y=0,4\end{cases}\) \(\Leftrightarrow\begin{cases}x=0,2\\y=0,1\end{cases}\)
Vậy : mAl = 0,2 . 27 = 5,4 (g)
mMg = 7,8 - 5,4 = 2,4 (g)