Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nZn=0,1 mol
nHCl=0,25 mol
Zn +2HCl=>ZnCl2+H2
Pứ 0,1 mol>=0,2 mol. =>0,1 mol
Dư 0,05 mol
VH2=2,24lit
HCl còn dư:0,05 mol
=>mHCl dư=1,825g

a) \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,25}{2}\) => Zn hết, HCl dư
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,1--->0,2------------>0,1
=> VH2 = 0,1.22,4 = 2,24 (l)
b) mHCl(dư) = (0,25 - 0,2).36,5 = 1,825 (g)

Zn + 2HCl \(\rightarrow\) ZnCl2 + H2
nZn = \(\dfrac{6,5}{65}=0,1mol\)
nHCl = \(\dfrac{60.7,3\%}{36,5}=0,12mol\)
Lập tỉ lệ: nZn : nHCl = \(\dfrac{0,1}{1}:\dfrac{0,12}{2}=0,1:0,06\)
=> Zn dư
nZn dư = 0,1 - 0,06 = 0,04 mol
=> mZn dư = 0,04 . 65 = 2,6g
\(n_{Zn}=\dfrac{6.5}{65}=0.1\left(mol\right)\)
\(n_{HCl}=\dfrac{60\cdot7.3}{100\cdot36.5}=0.12\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(1...........2\)
\(0.1.........0.12\)
\(LTL:\dfrac{0.1}{1}>\dfrac{0.12}{2}\Rightarrow Zndư\)
\(n_{H_2}=\dfrac{0.12}{2}=0.06\left(mol\right)\)
\(V_{H_2}=0.06\cdot22.4=1.344\left(l\right)\)
\(m_{Zn\left(dư\right)}=\left(0.1-0.06\right)\cdot65=2.6\left(g\right)\)

PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\n_{HCl}=0,25\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,25}{2}\) \(\Rightarrow\) HCl còn dư, Kẽm p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{H_2}=0,1\left(mol\right)\\n_{HCl\left(dư\right)}=0,05\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=22,4\cdot0,1=2,24\left(l\right)\\m_{HCl\left(dư\right)}=0,05\cdot36,5=1,825\left(g\right)\end{matrix}\right.\)

\(a,Zn+2HCl\to ZnCl_2+H_2\\ b,n_{Zn}=\dfrac{13}{65}=0,2(mol);n_{HCl}=\dfrac{21,9}{36,5}=0,6(mol)\)
Vì \(\dfrac{n_{Zn}}{1}<\dfrac{n_{HCl}}{2}\) nên \(HCl\) dư
\(n_{HCl(dư)}=0,6-0,2.2=0,2(mol)\\ c,n_{ZnCl_2}=n_{H_2}=n_{Zn}=0,2(mol)\\ \Rightarrow m_{ZnCl_2}=0,2.136=27,2(g)\\ V_{H_2}=0,2.22,4=4,48(l)\)

a)\(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(m\right)\)
\(n_{Fe_2O_3}=\dfrac{48}{160}=0,3\left(m\right)\)
\(PTHH:Fe_2O_3+3H_2\underrightarrow{ }2Fe+3H_2O\)
ta có tỉ lệ:\(\dfrac{0,45}{3}< \dfrac{0,3}{1}->H_2dư\)
H2 còn lại sau phản ứng
\(n_{H_2\left(dư\right)}=0,3-0,15=0,15\left(m\right)\)
\(m_{H_2\left(dư\right)}=0,15.2=0,3\left(g\right)\)
b)\(PTHH:Zn+2HCl\underrightarrow{ }ZnCl_2+H_2\)
tỉ lệ :1 2 1 1
số mol :0,15 0,3 0,15 0,15
\(m_{Zn}=0,15.65=9,75\left(g\right)\)

Pt: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(n_{Zn}=\dfrac{3,25}{65}=0,05mol\)
\(n_{HCl}=\dfrac{43,8}{36,5}=1,2mol\)
Lập tỉ lệ:
nZn : nHCl = \(\dfrac{0,05}{1}:\dfrac{1,2}{2}=0,05:0,6\)
=> HCl dư
nHCl dư = 1,2 - 0,05 = 1,15 mol
mHCl dư = 1,15 . 36,5 = 41,975g
b) Theo pt: nH2 = nZn = 0,05 mol
=> VH2 = 0,05.22,4=1,12lit
đề có sai chỗ 43,8 g HCl ko, số hơi to
\(a) n_{Zn} = \dfrac{3,25}{65} = 0,05(mol)\ ; n_{HCl} = \dfrac{43,8}{36,5} = 1,2(mol)\\ Zn + 2HCl \to ZnCl_2 + H_2\\ n_{HCl} = 1,2 > 2n_{Zn} = 0,1 \to HCl\ dư\\ n_{HCl\ pư} = 2n_{Zn} = 0,1(mol)\\ \Rightarrow m_{HCl\ dư} = 43,8 - 0,1.36,5 = 40,15(gam)\\ c) n_{H_2} = n_{Zn} = 0,05(mol) \Rightarrow V_{H_2} = 0,05.22,4 = 1,12(lít)\)

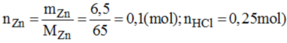
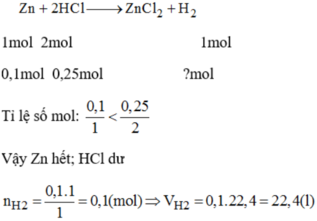
HCl dư: