Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi số mol CH 3 COOH là x
số mol CH 3 COO C 2 H 5 là y.
Phương trình hoá học của phản ứng giữa axit và este với NaOH :
CH 3 COOH + NaOH → CH 3 COONa + H 2 O
x mol x mol
CH 3 COO C 2 H 5 + NaOH → CH 3 COONa + C 2 H 5 OH
y mol y mol y mol
Số mol NaOH phản ứng là : x + y = 300/1000 x 1 = 0,3 mol
Phương trình hoá học của phản ứng giữa rượu etylic với Na :
2 C 2 H 5 OH + Na → 2 C 2 H 5 ONa + H 2
y y/2
Ta có y/2 = 2,24/22,4 = 0,1 => y = 0,2
Thay y = 0,2 vào phương trình x + y = 0,3, ta có :
x = 0,3 - 0,2 = 0,1 (mol).
Vậy khối lượng axit axetic là : 60 x 0,1 = 6 (gam). Khối lượng etyl axetat là : 88 x 0,2 = 17,6 (gam).
Khối lượng hỗn hợp là : 6 + 17,6 = 23,6 (gam).
Vây % khối lương axit axetic = 6/23,6 × 100% = 25,42%
% khối lượng etyl axetat là 100% - 25,42% = 74,58%.

Phần 2: do tác dụng với NaOH dư sinh ra H2 => Al dư
n H2 = 0,84 / 22,4 = 0,0375
Al + NaOH + H2O = NaAlO2 + 3/2 H2
0,025....................................
=> n Al dư = 0,025
Phần 1: n H2 = 3,08 / 22,4 = 0,1375
Al + 3H2SO4 = Al2(SO4)3 + 3H2
0,025_________________0,075
Fe + H2SO4 = FeSO4 + H2
0,0625..........................0,0625
* n Al2O3 = n Fe = 0,0625 => n Al phản ứng = 0,125
=> n Al = 0,125 + 0,025 = 0,15 => m Al = 4,05 (g)
* n Fe2O3 = n Fe/2 = 0,03125 => m Fe2O3 = 5 (g)
=> m hh = 2(m Fe + m Al) = 2(5 + 4,05) = 18,1 (g)
\(2Al+Fe_2O_3\rightarrow2Fe+Al_2O_3\)
Vậy chất rắn Y là \(Al_2O_3\) ;Fe và Al dư
Phần 1 \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\) (1)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\) (2)
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\) (3)
\(n_{H_2}=0,1375\left(mol\right)\)
Phần 2 \(Al_2O_3+2NaOH\rightarrow2NaAlO_2+H_2O\) (4)
\(2Al+2H_2O+2NaOH\rightarrow2NaAlO_2+H_2\uparrow\) (5)
\(n_{H_2}=\dfrac{0,84}{22,4}=0,0375\left(mol\right)\)
Theo (5) \(n_{Al}=0,025\left(mol\right)\)
Theo (2) và (1) \(n_{H_2}=0,1\left(mol\right)\Rightarrow n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow\)\(\sum n_{Fe}=0,1\left(mol\right)\rightarrow m_{Fe_2O_3}=0,1\times160=16\left(g\right)\)
\(\sum n_{Al}=\left(0,2+0,05\right)\times27=6,75\left(g\right)\)
Vậy \(m=16+6,75=22,75\left(g\right)\)

Gọi số mol của Fe và Cu trong hỗn hợp lần lượt là x và y.
2Fe + 3Cl2 → 2FeCl3 (1)
x(mol) x(mol)
Cu + Cl2 → CuCl2 (2)
y(mol) y(mol)
Fe + 2HCl → FeCl2 + H2 (3)
x (mol) 2x(mol) x(mol).
Theo điều kiện bài toán và phương trình hoá học (3) ta có: 127x = 25,4 → x = 0,2
Theo phương trình phản ứng (1) và (2) ta có: 162,5x + 135y = 59,5
Vậy y = 0,2.
Khối lượng mỗi muối là: m FeCl3=32,5gam
m CuCl2=27gam
%FeCl3 = 54,62%.
%CuCl2 = 45,38%

Phần trăm khối lượng của C 2 H 5 OH : 0,92/1,52 x 100% = 60,53%
Phần trăm khối lượng của C 3 H 7 OH : 100% - 60,53% = 39,47%.

mdd giảm = m↓ - mCO2 → mCO2 = 10 - 3,4 = 6,6 gam → nCO2 = 6,6 : 44 = 0,15 mol.
C6H12O6 enzim−−−−→30−35oC→30-35oCenzim2C2H5OH + 2CO2
Theo phương trình: nC6H12O6 = 0,15 : 2 = 0,075 mol.
Mà H = 90% → nC6H12O6 = 0,075 : 90% = 1/12 mol → m = 180 x 1/12 = 15 gam

Theo đề bài: cho A phản ứng với dung dịch NaOH thu được glixerol và 2 muối của 2 axit đơn chức, A chỉ chứa 1 loại nhóm chức
=> A là este 3 chức phản ứng với NaOH theo tỷ lệ mol 1:3 tạo ra 0,02 mol glixerol nên tiêu thụ 0,06 mol NaOH, tạo ra 0,04 mol 1 muối và 0,02 mol muối còn lại.
A + 3NaOH → C3H5(OH)3 + 2R1COONa + R2COONa
0,06 ← 0,02 → 0,04 → 0,02
=> nNaOH dư = 0,025.4 – 0,06 = 0,04 mol
Ta lại có: Axit X ít hơn Y 2 nguyên tử C và có cùng số nguyên tử H.
=> Gọi CTPT của các muối của X, Y với số mol tương ứng là CnHmCOONa x mol và Cn+2HmCOONa y mol.
Bảo toàn Na ta có:
nNa2CO3 = 1/2nNaOH bđ = 0,05 mol
Dẫn hỗn hợp khí và hơi sau khi đốt cháy B vào dung dịch Ba(OH)2 dư thì xảy ra phản ứng: Ba(OH)2 + CO2 → BaCO3 + H2O
=> nCO2 = nBaCO3 = 195,03/197 = 0,99 mol
Bảo toàn C ta có (n+1)x + (n+3)y = 0,05 + 0,99 =1,04 (*)
Xét 2 trường hợp có thể có với este A.
Trường hợp 1: A chứa 2 gốc axit X và 1 gốc axit Y
=> x = 0,04 mol, y = 0,02 thay vào (*) thì n = 15,67 vô lí (loại).
Trường hợp 2: A chứa 2 gốc axit Y và 1 gốc axit X
=> x = 0,02 mol, y = 0,04 mol thay vào (*) thì n =15
Khi đó 19,24 gam hỗn hợp B gồm: C15HmCOONa 0,02 mol, C17HmCOONa 0,04 mol và NaOH dư 0,04 mol.
=> 0,02(247 + m) + 0,04(271 + m) + 0,04 . 40 = 19,24
=> m = 31 (thỏa mãn)
=> 2 muối thu được là C15H31COONa và C17H31COONa
Este A có dạng:
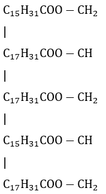
CTPT của A là C55H98O6

1.Gọi số mol của C2H5OH và hỗn hợp CnH2n+1COOH là a và b (mol)
Phần 1: nH2 = 3,92 : 22,4 = 0,175 (mol)
2C2H5OH + 2Na → 2C2H5ONa + H2↑
a → 0,5a (mol)
2CnH2n+1COOH + 2Na → 2CnH2n+1COONa + H2↑
b → 0,5b (mol)
Phần 2:
C2H6O + O2 → 2CO2 + 3H2O
a → 2a → 3a (mol)
Cn+1H2n+2O2 + (3n+1)/2O2 → ( n+1) CO2 + ( n+1) H2O
b → (n+1)b → (n+1)b (mol)
Sản phẩm cháy gồm CO2 và H2O
Khi cho qua bình đựng H2SO4 đặc thì H2O bị hấp thụ , khi cho qua bình 2 đựng Ca(OH)2 dư thì CO2 bị hấp thụ
=> mb1 tăng = mH2O = 17,1 (g) => nH2O = 17,1 : 18 = 0,95 (mol)
CO2 + Ba(OH)2 dư → BaCO3↓ + H2O
nBaCO3 = 147,75 : 197 = 0,75 (mol)
Ta có:
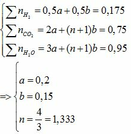
Vì 2 axit hữu cơ là đồng đẳng kế tiếp => 1< n = 4/3 < 2
Vậy CTCT của 2 axit hữu cơ là CH3COOH và C2H5COOH
2. Gọi số mol của CH3COOH và C2H5COOH lần lượt là x và y (mol)

Tk :Lazi