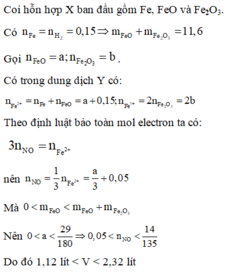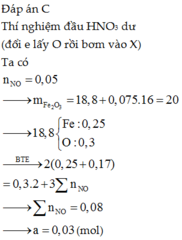Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
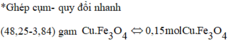
→ 48,24 gam hỗn hợp ban đầu gồm 0,15 mol Fe 3 O 4 và (0,15 + 3,84 : 64 = 0,21 mol) Cu.
Sơ đồ gộp quá trình:
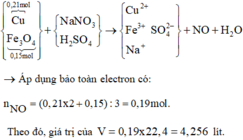

Đáp án C
Gọi số mol của Cu và F e 3 O 4 lần lượt là x, y mol
Nhận thấy kim loại còn dư là Cu (0,06 mol) => dung dịch chứa C u S O 4 : x - 0 , 6 và F e S O 4 : 3 y m o l
Bảo toàn nhóm
![]()
![]()
Ta có hệ
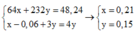
Vì N a N O 3 dư, H 2 S O 4 dư nên khí NO tính theo Cu và F e 3 O 4
Bảo toàn electron cho toàn bộ quá trình
![]()
![]()
=> V = 4,256 lit

Đáp án C
Gọi số mol của Cu và F e 3 O 4 lần lượt là x, y mol
Nhận thấy kim loại còn dư là ![]() dung dịch chứa
dung dịch chứa
![]() và
và
Bảo toàn nhóm
![]()
![]()
Ta có hệ
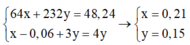
Vì N a N O 3 dư, H 2 S O 4 dư nên khí NO tính theo Cu và F e 3 O 4
Bảo toàn electron cho toàn bộ quá trình ![]()
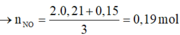
![]()

Đáp án B
- Khi cho hỗn hợp tác dụng với H2SO4 loãng dư chỉ có Mg phản ứng sinh ra khí H2 => nMg=nH2=0,15 mol
- Khi cho hỗn hợp tác dụng với HNO3 dư => Chỉ có Cu và Mg (kim loại thay đổi số oxi hóa)
BT e: nCu=(3nNO-2nMg)/2=0,15 mol
=>mCu=0,15.64=9,6 gam

X + NaOH ⟶3/2 H2; nA1 = 0,02
CO2 + NaAlO2 + H2O ⟶ NaHCO3 + Al(OH)3
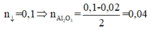
⇒ m = 10,26g
Đáp án A

Đáp án A
![]()
Sau phản ứng còn lại 0,2m gam chất rắn.
=>kim loại dư
=> n H 2 O = 0,8 ÷ 2 = 0,4 mol; n N O = 0,8 ÷ 4 = 0,2 mol
Bảo toàn khối lượng:
m + 0,4.63 + 0,2.98 = 0,2m + 50 + 0,4.18 + 0,2.30
=> m = 23(g)
=> chọn A