Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) mAl = 7,5 . \(\frac{36}{100}\)= 2,7 (g)
=> nAl = \(\frac{2,7}{27}=0,1\) mol
mMg = mhh - mAl = 7,5 - 2,7 = 4,8 (g)
=> nMg = \(\frac{4,8}{24}=0,2\) mol
Pt: 2Al + 6HCl --> 2AlCl3 + 3H2
.0,1 mol-----------> 0,1 mol-> 0,15 mol
......Mg + 2HCl --> MgCl2 + H2
...0,2 mol--------> 0,2 mol--> 0,2 mol
mAlCl3 = 0,1 . 133,5 = 13,35 (g)
mMgCl2 = 0,2 . 95 = 19 (g)
mhh muối khan = mAlCl3 + mMgCl2 = 13,35 + 19 = 32,35 (g)
b) VH2 = (0,15 + 0,2) . 22,4= 7,84 (lít)

do còn kim loại không tan nên Fe--> Fe2+
Quy hh oxit về Fe và O
Ta có:
Fe--> Fe2+ +2e
x------------>2x
O+2e-->O2-
N+5 +3e--> N+2
2x=(m-1,46-56x)/8 +0,1.3 <=> 9x=m/8+0,1775
Mặt khác theo bảo toàn điện tích thì 2x=nNO3-(dd sau pu)=nHNO3-nNO=0,64-0,1=0,54
=> m=18,02 gam
mình không chắc là bạn đúng hay sai nhưng khác với kết quả của cô giáo

a)
\(Mg + 2HCl \to MgCl_2 + H_2\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ Zn + 2HCl \to ZnCl_2 + H_2\)
b)
Gọi : \(n_{H_2} = a(mol) \Rightarrow n_{HCl} = 2a\)
Bảo toàn khối lượng :
\(13,5 + 2a.36,5 = 66,75 + 2.a\\ \Rightarrow a = 0,75\\ \Rightarrow V = 0,75.22,4 = 16,8(lít)\)
a) Mg + 2 HCl -> MgCl2 + H2
2Al + 6 HCl -> 2 AlCl3 + 3 H2
Fe + 2 HCl -> FeCl2 + H2
Zn + 2 HCl -> ZnCl2 + H2
b) mY-mX=mCl
<=> mCl= 66,75-13,5=53,25(g)
=>nCl=53,25/35,5=1,5(mol)
=> nH2= nCl/2= 1,5/2=0,75(mol)
=>V=V(H2,đktc)=0,75.22,4=16,8(l)

a) PTHH: Mg + H2SO4 loãng \(\rightarrow\) MgSO4 + H2 \(\uparrow\)
2Al + 3H2SO4 loãng \(\rightarrow\) Al2(SO4)3 + 3H2 \(\uparrow\)
b) Gọi x,y lần lượt là số mol của Mg,Al có trong 6,3g hh ( x,y > 0 )
n\(H_2\) = \(\frac{6,72}{22,4}=0,3\left(mol\right)\)
Theo đề, ta có: mMg + mAl = 6,3
=> 24x + 27y = 6,3 (*)
Theo PT(1) : n\(H_2\) = nMg = x (mol)
Theo PT(2): n\(H_2\) = \(\frac{3}{2}\)nAl = \(\frac{3y}{2}\)(mol)
Vì n\(H_2\) =0,3(mol) => n\(H_2\)(1) + n\(H_2\)(2) = 0,3 (mol)
=> x + \(\frac{3}{2}y\) = 0,3 (**)
Từ (*) và (**) => \(\left\{{}\begin{matrix}24x+27y=6,3\\x+\frac{3}{2}y=0,3\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,15\\y=0,1\end{matrix}\right.\)
=> mMg = 24.0,15 =3,6 (g)
Vậy thành phần % theo m mỗi kim loại trong hhA lần lượt là:
%mMg = \(\frac{3,6}{6,3}.100\%\approx57,143\%\)
%mAl = 100% - 57,143% =42,857%
+PTHH
Mg + H2SO4 => MgSO4 + H2
2Al + 3H2SO4 => Al2(SO4)3 + 3H2
nH2 = V/22.4 = 6.72/22.4 = 0.3 (mol)
Gọi x (mol), y (mol) lần lượt là số mol của Mg và Al
Ta có: \(\left\{{}\begin{matrix}24x+27y=6.3\\x+1.5y=0.3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0.15\\y=0.1\end{matrix}\right.\)
mMg = n.M = 0.15 x 24 = 3.6 (g)
mAl = n.M = 0.1 x 27 = 2.7 (g)
===> %mMg = 57.14 (%), %mAl = 42.86 (%)

a)\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
b)\(n_{H_2}:\dfrac{22,4}{22,4}=1\left(mol\right)\)
Gọi x, y lần lượt là số mol Zn, Fe
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
1.............................................1(mol)
x..............................................x(mol)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
1...........................................1(mol)
y............................................y(mol)
Ta có:\(\left\{{}\begin{matrix}65x+56y=60,5\\x+y=1\end{matrix}\right.\)
=>x=0,5,y=0,5
\(m_{Zn}:0,5.65=32,5\left(g\right)\)
\(m_{Fe}:0,5.56=28\left(g\right)\)

\(a.2Al+6HCl->2AlCl_3+3H_2\\ Mg+2HCl->MgCl_2+H_2\\ b.n_{Al}=a,n_{Mg}=b\\ 27a+24b=7,5\left(I\right)\\ 1,5a+b=\dfrac{7,84}{22,4}=0,35\left(II\right)\\ a=0,1;b=0,2\\ \%m_{Al}=\dfrac{27\cdot0,1}{7,5}\cdot100\%=36\%\\ \%m_{Mg}=64\%\\ c.m_{HCl}=36,5\left(0,1\cdot3+0,2\cdot2\right)=18,25g\\ d.m_{ddsau}=7,5+\dfrac{18,25}{14,6:100}-0,35\cdot2=131,8g\\ C\%\left(AlCl_3\right)=\dfrac{133,5\cdot0,1}{131,8}\cdot100\%=10,1\%\\ C\%\left(MgCl_2\right)=\dfrac{95\cdot0,2}{131,8}\cdot100\%=14,4\%\)

a) PTHH: \(Ca+H_2SO_4\rightarrow CaSO_4+H_2\uparrow\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
b) Ta có: \(\Sigma n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
Theo các PTHH, ta thấy \(n_{H_2SO_4}=n_{H_2}=0,5\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=0,5\cdot98=49\left(g\right)\)
Mặt khác: \(m_{H_2}=0,5\cdot2=1\left(g\right)\)
Bảo toàn khối lượng: \(m_{hh}=m_{muối}+m_{H_2}-m_{H_2SO_4}=68+1-49=20\left(g\right)\)
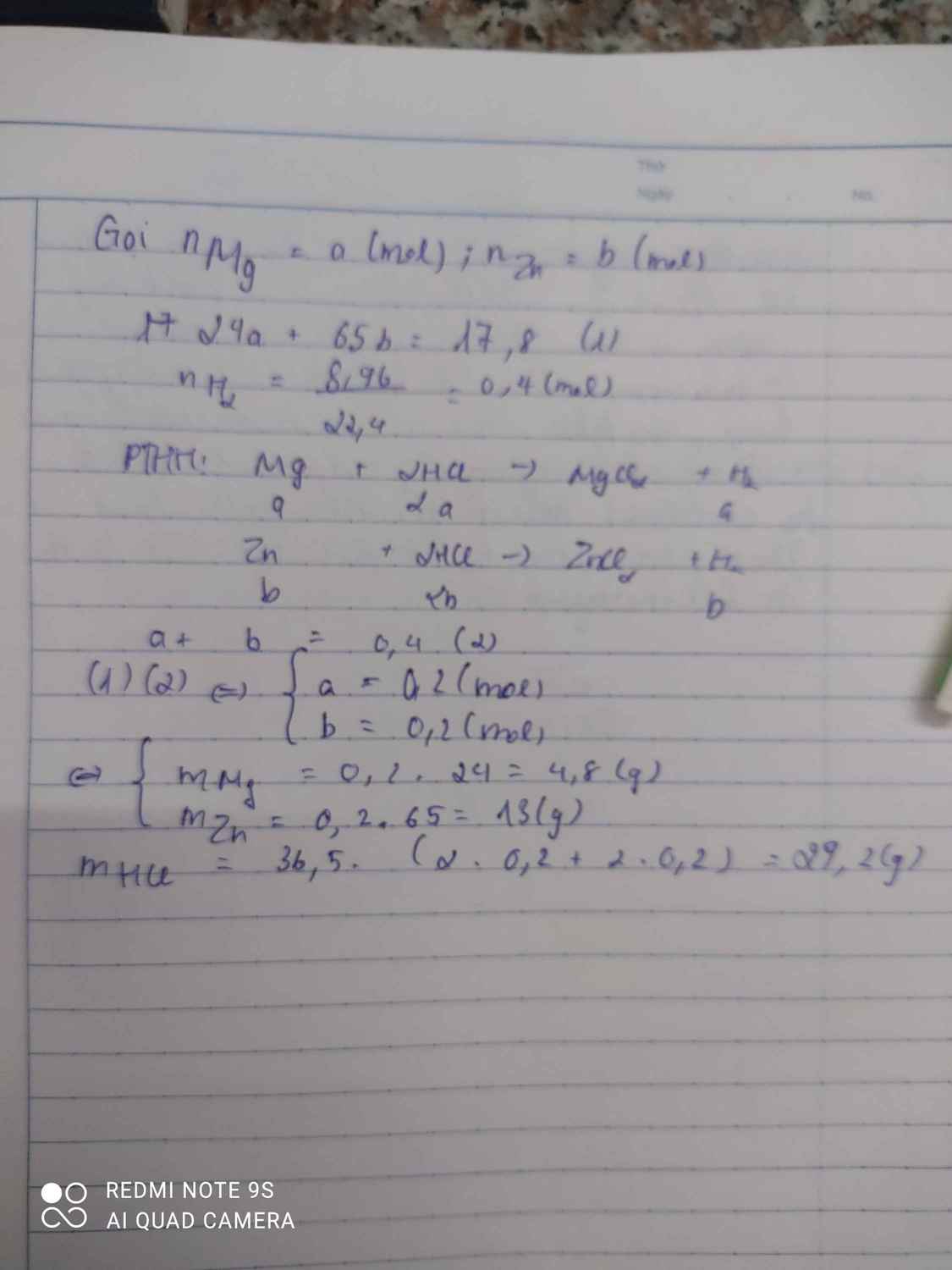
Đề thiếu dữ kiện rồi em !
k thiếu nha