Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a. PTHH: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
b. Có \(n_{Mg}=\frac{3,6}{24}=0,15mol\)
\(140ml=0,14l\)
\(n_{H_2SO_4}=0,14.1,2=0,168mol\)
Lập tỉ lệ \(\frac{n_{Mg}}{1}< \frac{n_{H_2SO_4}}{1}\)
Vậy Mg đủ, \(H_2SO_4\) dư
Theo phương trình \(n_{H_2SO_4}=n_{Mg}=0,15mol\)
\(\rightarrow n_{H_2SO_4\left(\text{(dư)}\right)}=0,168-0,15=0,018mol\)
\(\rightarrow m_{H_2SO_4\left(\text{(dư)}\right)}n.M=0,018.98=1,764g\)
c. MgSO\(_4\) là muối
Theo phương trình \(n_{MgSO_4}=n_{Mg}=0,15mol\)
\(\rightarrow m_{\text{muối}}=m_{MgSO_4}=n.M=0,15.120=18g\)
d. \(H_2\) là khí
Theo phương trình \(n_{H_2}=n_{Mg}=0,15mol\)
\(\rightarrow V_{H_2\left(ĐKTC\right)}=n.22,4=0,15.22,4=3,36l\)

Số mol H2 = 2,24 : 22,4 = 0,1 mol.
a) Khi cho hỗn hợp (Zn, Cu) vào dung dịch H2SO4 loãng, chỉ có Zn phản ứng:
Zn + H2SO4 \(\rightarrow\) ZnSO4 + Н2
Phản ứng: 0,1 \(\leftarrow\) 0,1 (mol)
b) Chất rắn còn lại là Cu. mCu = 10,5 - 0,1 x 65 = 4 gam.
nkhí = 2,24 / 22,4 = 0,1 mol
a) Phương trình hóa học của phản ứng:
Zn + H2SO4 loãng → ZnSO4 + H2
nZn = 0,1 mol.
b) Khối lượng chất rắn còn lại: mZn = 6,5g
Khối lượng chất rắn còn lại: mCu = 10,5 – 6,5 = 4g.

PTHH:
2Al+6HCl→2AlCl3+3H2
Fe+2HCl→FeCl2+H2
2NaOH+FeCl2→2NaCl+Fe(OH)2
3NaOH+AlCl3→3NaCl+Al(OH)3
NaOH+Al(OH)3→NaAlO2+2H2O
4Fe(OH)2+O2→2Fe2O3+4H2O
CO2+NaAlO2+2H2O→Al(OH)3+NaHCO3

nFe = 0,1 mol; nS = 0,05 mol
a) Phương trình phản ứng:
Fe + S → FeS (1)
nFe dư = 0,1 – 0,05 = 0,05 nên hỗn hợp chất rắn A có Fe và FeS.
Fe + 2HCl → FeCl2 + H2↑ (2)
FeS + 2HCl → FeCl2 + H2S↑ (3)
b) Dựa vào phương trình phản ứng (2) và (3), ta có:
nHCl= 0,1 + 0,1 = 0,2 mol
VHCl = 0,2 /1 = 0,2 lít.

\(n_{CH_4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Gọi số mol C2H4, C2H2 là a, b (mol)
=> \(a+b=\dfrac{6,72}{22,4}-0,1=0,2\left(mol\right)\) (1)
\(n_{Br_2}=\dfrac{48}{160}=0,3\left(mol\right)\)
PTHH: C2H4 + Br2 --> C2H4Br2
a--->a
C2H2 + 2Br2 --> C2H2Br4
b---->2b
=> a + 2b = 0,3 (2)
(1)(2) => a = 0,1 (mol); b = 0,1 (mol)
\(\%m_{CH_4}=\dfrac{0,1.16}{0,1.16+0,1.28+0,1.26}.100\%=22,857\%\)
\(\%m_{C_2H_4}=\dfrac{0,1.28}{0,1.16+0,1.28+0,1.26}.100\%=40\%\)
\(\%m_{C_2H_2}=\dfrac{0,1.26}{0,1.16+0,1.28+0,1.26}.100\%=37,143\%\)

nFe = = 0,1 mol; ns =
= 0,05 mol.
a) Phương trình hoá học: Fe + S FeS.
Lúc ban đầu: 0,1 0,05 0 (mol)
Lúc phản ứng: 0,05 0,05 0,05
Sau phản ứng: 0,05 0 0,05
Chất rắn A gồm FeS và Fe dư + HCl?
FeS + 2HCl → FeCl2 + H2S
Phản ứng: 0,05 0,1 0,05 0,05 (mol)
Fe + 2HCl → FeCl2 + H2
Phản ứng: 0,05 0,1 0,05 0,05 (mol).
Số mol HCl tham giá phản ứng = 0,1 + 0,1 = 0,2 mol.
Thể tích dung dịch HCl 1M dùng là: Vdd = =
= 0,2 lít.

\(n_{MgCO3}=\dfrac{8,4}{84}=0,1\left(mol\right)\)
a) Pt : \(2CH_3COOH+MgCO_3\rightarrow\left(CH_3COO\right)_2Mg+CO_2+H_2O|\)
2 1 1 1 1
0,2 0,1 0,1 0,1
b) \(n_{CH3COOH}=\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
⇒ \(m_{CH3COOH}=0,2.60=12\left(g\right)\)
\(C_{ddCH3COOH}=\dfrac{12.100}{200}=6\)0/0
\(n_{\left(CH3COO\right)2Mg}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
⇒ \(m_{\left(CH3COO\right)2Mg}=0,1.142=14,2\left(g\right)\)
\(m_{ddspu}=8,4+200-\left(0,1.44\right)=204\left(g\right)\)
\(C_{dd\left(CH3COO\right)2Mg}=\dfrac{14,2.100}{204}=6,96\)0/0
Chúc bạn học tốt

nA = = 0,015625 mol.
MA = = 64g
- Tìm số nguyên tử S, O trong phân tử A?
mO = 64 x = 32g => nO =
= 2 mol
mS = 64 - 32 = 32g => ns = = 1 mol
Suy ra trong 1 phân tử A có 1S và 2O, công thức của A là SO2
b) Khi dẫn SO2 vào dung dịch NaOH và SO2, có thể tạo thành muối trung hoà, muối axit hoặc cả hai muối:
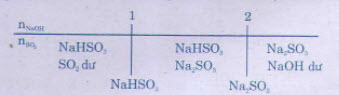
Bài 7*. a) Hãy xác định công thức của hợp chất khí A, biết rằng :
- A là oxit của lưu huỳnh chứa 50% oxi.
- 1 gam khí A chiếm thề tích là 0,35 lít ở đktc.
b) Hoà tan 12,8 gam hợp chất khí A vào 300 ml dung dịch NaOH 1,2M. Hãy cho biết muối nào thu được sau phản ứng. Tính nồng độ mol của muối (giả thiết thể tích dung dịch thay đổi không đáng kể).
Lời giải:
nA = = 0,015625 mol.
MA = = 64g
- Tìm số nguyên tử S, O trong phân tử A?
mO = 64 x = 32g => nO =
= 2 mol
mS = 64 - 32 = 32g => ns = = 1 mol
Suy ra trong 1 phân tử A có 1S và 2O, công thức của A là SO2
b) * Hướng dẫn: Khi dẫn SO2 vào dung dịch NaOH và SO2, có thể tạo thành muối trung hoà, muối axit hoặc cả hai muối:

\(C_2H_2+2Br_2->C_2H_2Br_4\\ n_{hh}=\dfrac{3,36}{22,4}=0,15mol\\ n_{CH_4}=\dfrac{2,24}{22,4}=0,1mol\\ n_{C_2H_2}=0,05mol\\ n_{Br_2}=2.0,05=0,1mol\\ m_{Br_2}=0,1.160=16g\\ \%V_{CH_4}=\dfrac{0,1}{0,15}.100\%=66,67\%\\ \%V_{C_2H_2}=33,33\%\)