Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

`Zn+H_2SO_4->ZnSO_4+H_2`(to)
0,45-------------------0,45------0,45mol
`n_(Zn)=(29,25)/65=0,45mol`
`m_(ZnSO_4)=0,45.161=72,45g`
`V_(H_2)=0,45.22,4=10,08l`
c) `H_2+CuO->Cu+H_2O`(to)
0,45--------0,45 mol
`n_(Cu)=40/80=0,5 mol`
=>Cu dư , 0,05 mol
`m_(chất rắn)=0,45.64+0,05.80=32,8g`
\(n_{Zn}=\dfrac{m}{M}=\dfrac{29,25}{65}=0,45\left(mol\right)\)
a) \(PTHH:Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
1 1 1 1
0,45 0,45 0,45 0,45
b) \(m_{ZnSO_4}=n.M=0,45.\left(65+32+16.4\right)=51,03\left(g\right)\\ V_{H_2}=n.24,79=0,45.24,79=11,1555\left(l\right)\)
c) \(n_{CuO}=\dfrac{m}{M}=\dfrac{40}{\left(64+16\right)}=0,5\left(mol\right)\)
\(PTHH:CuO+H_2\rightarrow Cu+H_2O\)
1 1 1 1
0,5 0,5 0,5 0,5
\(m_{Cu}=0,5.64=32\left(g\right).\)

a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Ta có: \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,2\left(mol\right)\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b, \(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,15}{1}< \dfrac{0,2}{1}\), ta được H2 dư.
Theo PT: \(n_{H_2\left(pư\right)}=n_{CuO}=0,15\left(mol\right)\Rightarrow n_{H_2\left(dư\right)}=0,2-0,15=0,05\left(mol\right)\)

\(n_{HCl}=0.2\cdot1=0.2\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(........0.2..............0.1\)
\(V_{H_2}=0.1\cdot22.4=2.24\left(l\right)\)
\(n_{CuO}=\dfrac{16}{80}=0.2\left(mol\right)\)
\(CuO+H_2\underrightarrow{^{t^0}}Cu+H_2O\)
\(0.1.......0.1....0.1\)
\(\Rightarrow CuOdư\)
\(m_{Cu}=0.1\cdot64=6.4\left(g\right)\)

a) Zn + 2HCl --> ZnCl2 + H2
b) \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,2--------------------->0,2
=> VH2 = 0,2.22,4 = 4,48 (l)
c) \(n_{CuO}=\dfrac{24}{80}=0,3\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,2}{1}\) => CuO dư, H2 hết
PTHH: CuO + H2 --to--> Cu + H2O
0,2<--0,2-------->0,2
=> nCuO(dư) = 0,3 - 0,2 = 0,1 (mol)
mCu = 0,2.64 = 12,8 (g)

`a)PTHH:`
`Zn + 2HCl -> ZnCl_2 + H_2 \uparrow`
`0,1` `0,2` `0,1` `(mol)`
`H_2 + CuO` $\xrightarrow{t^o}$ `Cu + H_2 O`
`0,1` `0,1` `(mol)`
`n_[Zn]=[6,5]/65=0,1(mol)`
`n_[HCl]=[10,95]/[36,5]=0,3(mol)`
Ta có: `[0,1]/1 < [0,3]/2`
`=>HCl` dư
`b)V_[H_2]=0,1.22,4=2,24(l)`
`m_[Cu]=0,1.64=6,4(g)`

\(n_{Zn}=\dfrac{19.5}{65}=0.3\left(mol\right)\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(0.3........................0.3..........0.3\)
\(m_{ZnSO_4}=0.3\cdot161=48.3\left(g\right)\)
\(V_{H_2}=0.3\cdot22.4=6.72\left(l\right)\)
\(n_{CuO}=\dfrac{16}{80}=0.2\left(mol\right)\)
\(CuO+H_2\underrightarrow{^{^{t^0}}}Cu+H_2O\)
\(0.2..........0.3\)
\(LTL:\dfrac{0.2}{1}< \dfrac{0.3}{1}\Rightarrow H_2dư\)
\(m_{H_2\left(dư\right)}=\left(0.3-0.2\right)\cdot2=0.2\left(g\right)\)
a) $Zn + H_2SO_4 → ZnSO_4 + H_2$
b) n ZnSO4 = n Zn = 19,5/65 = 0,3(mol)
=> m ZnSO4 = 0,3.161 = 48,3(gam)
c) n H2 = n Zn = 0,3(mol)
V H2 = 0,3.22,4 = 6,72 lít
c)
$CuO + H_2 \xrightarrow{t^o} Cu + H_2O$
n CuO = 16/80 = 0,2(mol) < n H2 = 0,3 nên H2 dư
n H2 pư = n CuO = 0,2(mol)
=> m H2 dư = (0,3 - 0,2).2 = 0,2(gam)

a) $Zn + 2HCl \to ZnCl_2 + H_2$
$n_{H_2} = n_{Zn} = \dfrac{13}{65} = 0,2(mol)$
$V_{H_2} = 0,2.22,4 = 4,48(lít)$
b) $n_{CuO} = \dfrac{12}{80} = 0,15(mol)$
$CuO + H_2 \xrightarrow{t^o} Cu + H_2O$
Ta thấy :
$n_{CuO} : 1 < n_{H_2} : 1$ nên $H_2$ dư
$n_{H_2\ pư} = n_{CuO} = 0,15(mol)$
$n_{H_2\ dư} = 0,2 - 0,15 = 0,05(mol)$
$m_{H_2} = 0,05.2 = 0,1(gam)$
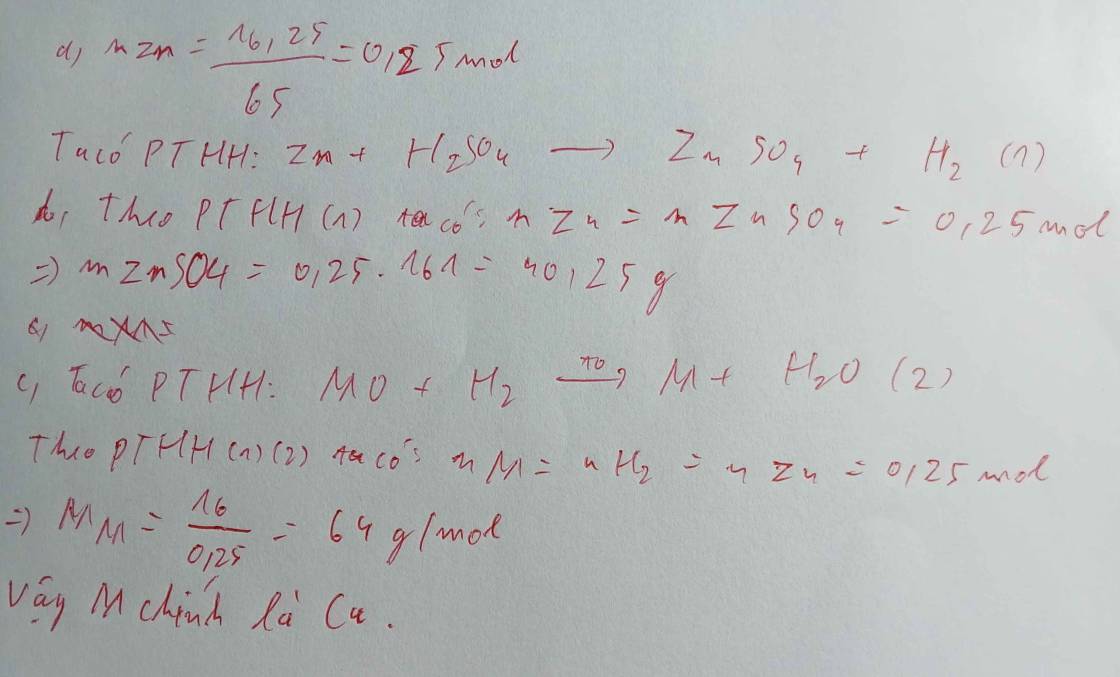
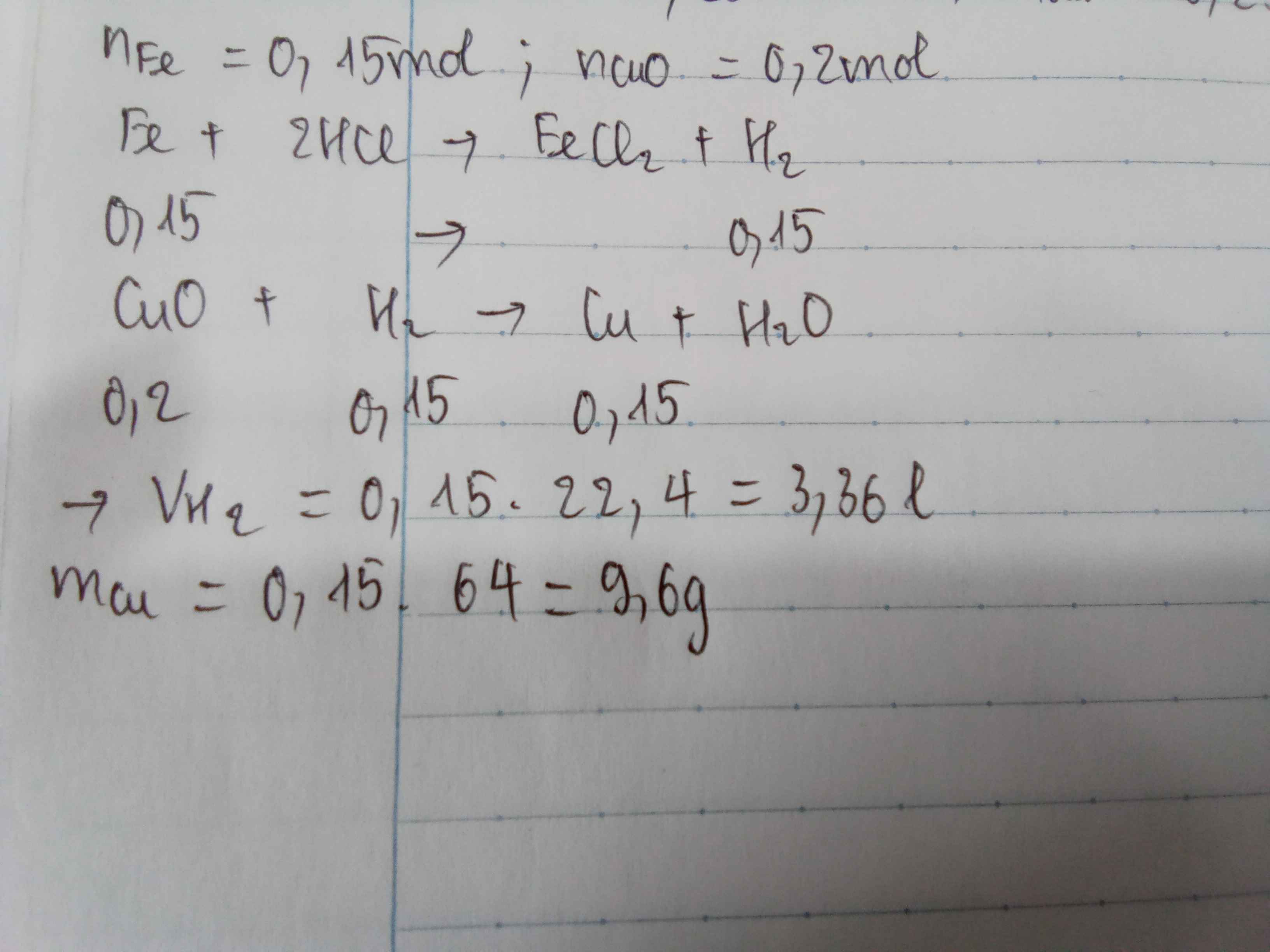

ta có phương trình :
Zn + H2SO4➞ ZnSO4 +H2
1 1 1 1
0,05 0,05 0,05 0,05
\(n_{Zn}\)=\(\frac{m}{M}\) =\(\frac{3,25}{65}\)=0,05 (mol)
vì H2 có cùng tỉ lệ với Zn nên số mol của H2 cũng = 0,05 mol
\(V_{H_2}\)= n . 22.4 =0,05.22,4=1,12(l) (đktc)
b/ H2 + CuO ➞ Cu +H2O
1 1 1 1
0,05 0,06
0,05 0,05
Theo đề bài thì thể tích khí hidro sinh ra là 1,12 l và khối lượng bột Đồng (II) oxit là 4,8
nCuO= \(\frac{m}{M}\)=\(\frac{4,8}{80}\)=0,06 (mol)
So sánh
\(n_{H_2}\)= \(\frac{0,05}{1}\)=0,05 < \(n_{CuO}\)= \(\frac{0,06}{1}=0,06\)
➞ CuO dư
➞ nCuO tham gia là 0,05 (mol)
➞ nCuO dư =\(0,06-0,05=0,01\left(mol\right)\)
➞ mCuO dư = nCuO dư . M = \(0,01.80=0,8\left(g\right)\)
Vậy sau phản ứng CuO dư và dư 0,8 (g)
nZn= 3.25/65=0.05 mol
Zn + H2SO4 --> ZnSO4 + H2
0.05__________________0.05
VH2= 0.05*22.4=1.12l
nCuO= 4.8/80=0.06 mol
CuO + H2 -to-> Cu + H2O
1______1
0.06____0.05
Lập tỉ lệ: 0.06/1 > 0.05/1 => CuO dư, H2 hết
nCuO dư= 0.06-0.05=0.01 mol
mCuO dư= 0.01*80=0.8g