Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4
0,025 < 0,15 < 0,05
Al2(SO4)3 + 8NaOH = 2NaAlO2 + 4H2O + 3Na2SO4
0,075...... 0,75-0,15=0,6
2Al(OH)3 = Al2O3 + 3H2O
0,05............0,025
nAl2O3=0,025 mol
=> Al(OH)3=0,05 mol
nNaOH = 0,75 mol
nAl2(SO4)3=0,02+0,075=0,1 mol
=> Cm=0,1:0,2=0,5M

a) nH2 = 0,4 mol
- Bảo toàn H : => nH2SO4 = nH2 = 0,4 (mol)
=> VH2SO4 = 0,4/0,5 = 0,8 lít
b) - Đặt nMg = x và nAl = y
=> 24x + 27y = 7,8 (I)
Mg (x) + H2SO4 -----> MgSO4 (x) + H2 (x) (1)
2Al (y) + 3H2SO4 ------> Al2(SO4)3 (0,5y)+ 3H2 (1,5y) (2)
- Theo PTHH (1,2); nH2 = x + 1,5y = 0,4 (II)
- Giải hệ PT (I;II) => x = 0,1 (mol) và y = 0,2 (mol)
=> mMg = 0,1 . 24 = 2,4 gam
=> %mMg = 30,77%
c) - dd X gồm: \(\left\{{}\begin{matrix}MgSO_4:0,1\left(mol\right)\\Al_2\left(SO_4\right)_3:0,1\left(mol\right)\end{matrix}\right.\)
nNaOH = 0,9 mol
MgSO4 (0,1) + 2NaOH (0,2) -----> Mg(OH)2 (0,1) + Na2SO4 (3)
Al2(SO4)3 (0,1) + 6NaOH (0,6) -----> 2Al(OH)3 (0,2) + 3Na2SO4 (4)
- Theo PTHH 3,4: nMg(OH)2 = 0,1 mol
=> mMg(OH)2 = 5,8 gam
- Theo PTHH 3,4: nNaOH = 0,8 mol
=> nNaOH dư = 0,1 mol
Al(OH)3 (0,1) + NaOH (0,1) -------> NaAlO2 +2H2O (5)
=> nAl(OH)3 sau phản ứng bằng 0,2 - 0,1 = 0,1 mol
=> mAl(OH)3 = 7,8 gam
=> m kết tủa sau phản ứng bằng: 7,8 + 5,8 = 13,6 gam

Câu 1:
Khối lượng CaO: 
Số mol CaO:
Pt:
 số mol Ca (OH)2
số mol Ca (OH)2
Vậy khối lượng Ca(OH)2tạo thành: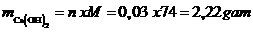
Vậy mct = 2,22 gam
 Mà
Mà 
Vậy nồng độ phần trăm Ca(OH)2: 
Câu 2:
+ Khối lượng riêng  khối lượng dd H2SO4 là
khối lượng dd H2SO4 là 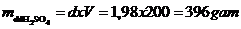
+ 
Số mol CuO: 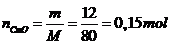
 Pt:
Pt: 

 Khối lượng
Khối lượng 
Vậy khối lượng chất tan: mct = 24 gam
Mà 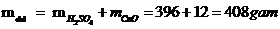
Vậy nồng độ phần trăm: 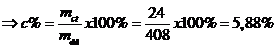

Na2SO4 + BaCl2 \(\rightarrow\)2NaCl + BaSO4
nNa2SO4=0,05.0,1=0,005(mol)
nBaCl2=0,1.0,1=0,01(mol)
Vì 0,005<0,01 nên BaCl2 dư 0,005(mol)
Theo PTHH ta có;
nNa2SO4=nBaSO4=0,005(mol)
2nNa2SO4=nNaCl=0,01(mol)
mBaSO4=0,005.233=1,165(g)
CM dd BaCl2=\(\dfrac{0,005}{0,15}=\dfrac{1}{30}M\)
CM dd NaCl=\(\dfrac{0,01}{0,15}=\dfrac{1}{15}M\)

\(n_{OH}=10Vmol\)
\(n_H=1,2mol\)
Có 2 trường hợp xảy ra để tạo \(H_2\).
1. Acid dư
2. Bazơ dư ( vì Al lưỡng tính )
Xét TH1:
\(n_H\) dư = ( 1,2 - 10V ) mol
----> \(n_{H_2}=0,15\rightarrow V=0,09\) ( lít ) = 90ml
Xét TH2:
\(n_{OH}\) dư = ( 10V - 1,2 ) mol
Ta có:
\(H_2O+Al+OH\left(-\right)\rightarrow AlO_2\left(-\right)+\dfrac{3}{2}H_2\)
\(\rightarrow n_{OH}=0,1mol\rightarrow V=0,13\) lít = 130ml.

2) Gọi a là thể tích của NaOH 0,5M cần tìm.
PTHH: 6NaOH + Al2(SO4)3 ---------> 3Na2SO4 + 2Al(OH)3
nAl2(SO4)3 = 0,02 mol
- Theo PTHH: nNaOH = 0,12 mol (I)
- Mặt khác nNaOH = 0,5.a mol (II)
-Từ (I) và (II) => 0,12 = 0,5 . a
=> a = 0,24 ( lít ) = 240 (ml)
Vậy để tạo kết tủa tối đa ta phải cần 240ml dd NaOH
Sau phản ứng tạo kết tủa Zn(OH)2 thì KOH còn dư 0,02mol. Do Zn(OH)2 có tính chất lưỡng tính nên sẽ tác dụng với KOH dư theo PTHH như sau:
Zn(OH)2 + 2KOH ---> K2ZnO2 + H2O
0,01.............0.02..............0,01
Vậy sau phản ứng còn dư lại 0,02 mol Zn(OH)2.
