Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\\
pthh:Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,3 0,3
\(V_{H_2}=0,3.22,4=6,72l\\ n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12g\\ pthh:Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\\ LTL:\dfrac{0,12}{1}>\dfrac{0,3}{3}\)
=> Fe2O3 dư
\(n_{Fe}=\dfrac{2}{3}n_{H_2}=0,2\left(mol\right)\\
m_{Fe}=0,2.56=11,2g\)
a.\(n_{Zn}=\dfrac{19,5}{65}=0,3mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,3 0,3 ( mol )
\(V_{H_2}=0,3.22,4=6,72l\)
b.\(n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,12 > 0,3 ( mol )
0,3 0,2 ( mol )
\(m_{Fe}=0,2.56=11,2g\)

nZn = 19.5/65 = 0.3 (mol)
Zn + 2HCl => ZnCl2 + H2
0.3................................0.3
VH2 = 0.3 * 22.4 = 6.72 (l)
nFe2O3 = 19.2/160 = 0.12 (mol)
Fe2O3 + 3H2 -t0-> 2Fe + 3H2O
Bđ: 0.12......0.3
Pư: 0.1........0.3..........0.2
Kt: 0.02.........0...........0.2
mFe = 0.2 * 56 = 11.2 (g)

\(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\\ PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{H_2}=n_{Zn}=0,3\left(mol\right)\\ a,V_{H_2\left(đktc\right)}=0,3.22,4=6,72\left(l\right)\\ b,n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12\left(mol\right)\\ PTHH:3H_2+Fe_2O_3\rightarrow\left(t^o\right)2Fe+3H_2O\\ Vì:\dfrac{0,3}{3}< \dfrac{0,12}{1}\Rightarrow Fe_2O_3dư,H_2.hết\\ n_{Fe}=\dfrac{2}{3}.n_{H_2}=\dfrac{2}{3}.0,3=0,2\left(mol\right)\\ m_{Fe}=0,2.56=11,2\left(g\right)\)

a) Nồng độ phần trăm dd KCl:
\(C\%_{ddKCl}=\dfrac{200}{600}.100\approx33,333\%\)
b) Nồng độ phần trăm dd NaCl:
\(C\%_{ddNaCl}=\dfrac{15}{15+45}.100=25\%\)
a, Nồng độ % của dung dịch KCl là :
C%ddKCl = \(\dfrac{mct}{m\text{dd}}.100\%=\dfrac{20}{600}.100\%\approx3,333\%\)
b, ta có
Khối lượng dung dịch NaCl là :
mdd=mct+mdm=15+45=60 g
=> Nồng độ % của dung dịch NaCl là :
C%ddNaCl = \(\dfrac{mct}{m\text{dd}}.100\%=\dfrac{15}{60}.100\%=25\%\)

Câu 5:
PTHH : H2+ Cl2 -to-> 2 HCl
Vì số mol , tỉ lệ thuận theo thể tích , nên ta có:
25/1 = 25/1 => P.ứ hết, không có chất dư, tính theo chất nào cũng được
=> V(HCl)= 2. V(H2)= 2. 25= 50(l)
Câu 4: mFe2O3= 0,6. 80= 48(g)
=> nFe2O3= 48/160=0,3(mol)
mCuO= 80-48=32(g) => nCuO=32/80=0,4(mol)
PTHH: CuO + CO -to-> Cu + CO2
0,4_______0,4_____0,4____0,4(mol)
Fe2O3 + 3 CO -to-> 2 Fe +3 CO2
0,3_____0,9____0,6______0,9(mol)
=>nCO= 0,4+ 0,9= 1,3(mol)
=> V(CO, đktc)= 1,3. 22,4=29,12(l)

a) +) Ta có: \(V_{ddKNO_3}=500\left(ml\right)=0,5\left(l\right)\\ =>n_{KNO_3}=0,5.2=1\left(mol\right)\\ =>m_{KNO_3}=1.101=101\left(g\right)\)
b) +) Ta có: \(V_{ddCaCl_2}=250\left(ml\right)=0,25\left(l\right)\\ =>n_{ddCaCl_2}=0,25.0,1=0,025\left(mol\right)\\ =>m_{CaCl_2}=111.0,025=2,775\left(g\right)\)

a) số mol của 19,5 gam Zn:
\(n_{Zn}=\dfrac{m}{M}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
Tỉ lệ : 1 : 1 : 1 : 1
0,3-> 0,3 : 0,3 : 0,3
thể tích của 0,3 mol H2:
\(V_{H_2}=n.22,4=0,3.22,4=6,72\left(l\right)\)
b) số mol của 19,2 gam Fe2O3:
\(n_{Fe_2O_3}=\dfrac{m}{M}=\dfrac{19,2}{160}=0,12\left(mol\right)\)
PTHH:
\(3H_2+Fe_2O_3\underrightarrow{t^o}2Fe+3H_2O\)
3 : 1 : 2 : 3
0,12-> 0,04 : 0,08 : 0,12 (mol)
Khối lượng của 0,08 mol Fe:
\(m_{Fe}=n.M=0,08.56=4,48\left(g\right)\)
PTHH: Zn + 2HCl ---> ZnCl₂ + H₂
1 2 1 1 ( mol)
a):Số mol Zn: nZn = 19,5 ÷ 65 = 0,3 mol.
Theo PTHH => Số mol H₂: nH₂ = 0,3 × 1 ÷ 1 = 0,3 mol
=> Thể tích H₂ (đktc): V = n × 22,4 = 0,3 × 22,4 = 6,72 lít
b) PTHH: Fe₂O₃ + 3H₂ --> 2Fe + 3H₂O
1 3 2 3 (mol)
*Lm tương tự nhưng thay vì tính thể tích thì tính KL Fe

a)
\(Zn+H2SO4\rightarrow ZnSO4+H2\)
\(2Al+3H2SO4\rightarrow Al2\left(SO4\right)3+3H2\)
\(Fe+H2SO4\rightarrow FeSO4+H2\)
b) giải sử khối KL cùng là \(m\left(g\right)\)
\(\Rightarrow n_{Zn}=\frac{m}{65}\Rightarrow n_{H_2}=\frac{m}{65}\)
\(\Rightarrow n_{Al}=\frac{m}{27}\Rightarrow n_{H_2}=1,5.\frac{m}{27}\)
\(\Rightarrow n_{Fe}=\frac{m}{56}\Rightarrow n_{H_2}=\frac{m}{56}\)
\(\Rightarrow Al\)
c) Giả sử : \(n_{H_2}=0,15mol\)
\(\Rightarrow n_{Zn}=0,15mol\Rightarrow m=9,75g\)
\(\Rightarrow n_{Al}=0,1mol\Rightarrow m=2,7g\)
\(\Rightarrow n_{Fe}=0,15mol\Rightarrow m=8,4g\)
\(\Rightarrow Al\)
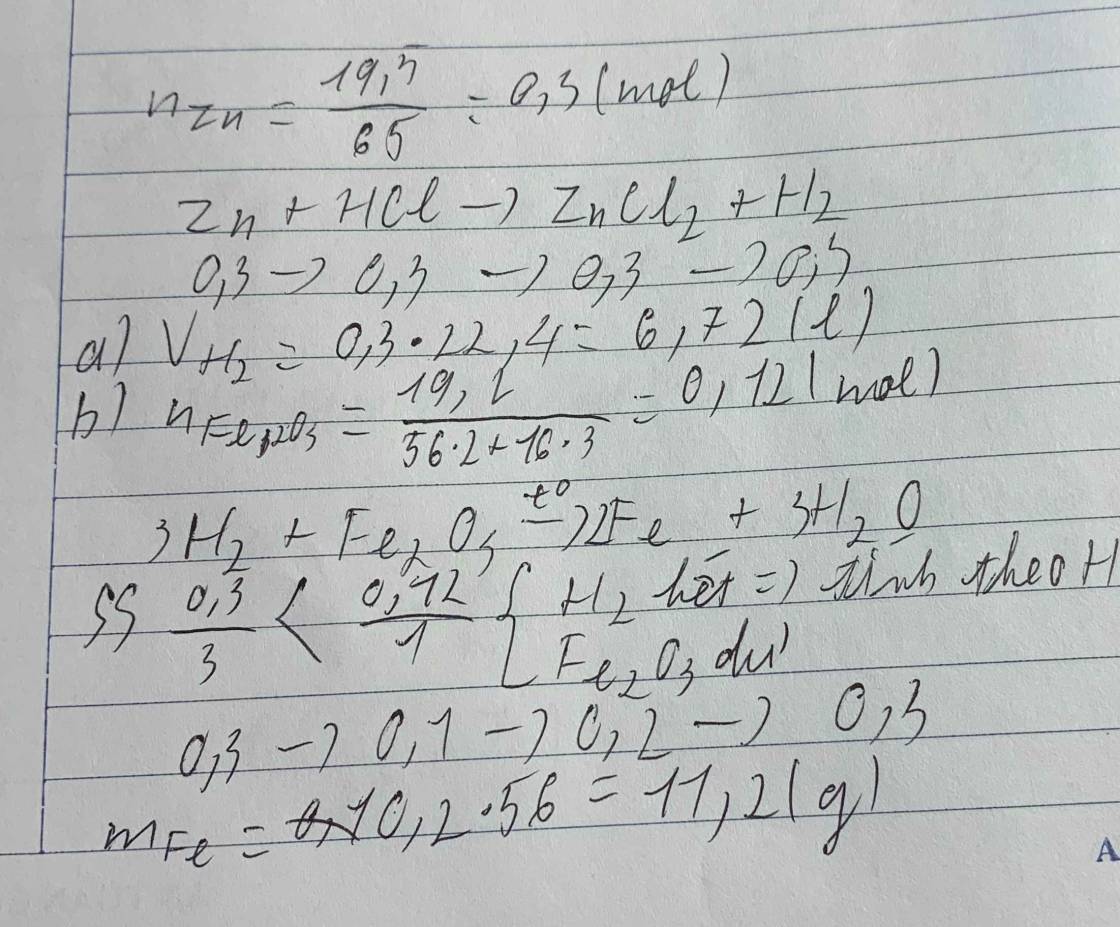

Ta có: \(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
PTHH: Zn + 2HCl -> ZnCl2 + H2 (1)
a) Ta có: \(n_{H_2}=n_{Zn}=0,3\left(mol\right)\\ =>V_{H_2\left(đktc\right)}=0,3.22,4=6,72\left(l\right)\)
b) PTHH: 3H2 + Fe2O3 -> 2Fe + 3H2O (2)
Ta có: \(\left\{{}\begin{matrix}n_{H_2\left(2\right)}=n_{H_2\left(1\right)}=0,3\left(mol\right)\\n_{Fe_2O_3\left(2\right)}=\dfrac{19,2}{160}=0,12\left(mol\right)\end{matrix}\right.\)
Ta có: \(\dfrac{0,3}{3}< \dfrac{0,12}{1}\)
=> Fe2O3 dư, H2 hết nên tính theo H2.
=> \(n_{Fe}=\dfrac{2.0,3}{3}=0,2\left(mol\right)\\ =>m_{Fe}=0,2.56=11,2\left(g\right)\)
a) PTHH: Zn + 2HCl --> ZnCl2 + H2
Ta có: nZn = \(\dfrac{19,5}{65}\) = 0,3 mol'
Theo PT: nZn = nH2 = 0,3 mol
=> VH2 = 0,3 x 22,4 = 6,72l
b) PTHH: Fe2O3 + 3H2 --> 2Fe + 3H2O
\(n_{Fe_2O_3}\) = \(\dfrac{19,2}{160}\) = 0,12 mol
Vì \(\dfrac{0,12}{1}>\dfrac{0,3}{3}\) => Fe2O3 dư
Cứ 3 mol H2 --> 2 mol Fe
0,3 mol --> 0,2 mol'
=> mFe = 0,2 x 56 = 11,2g