Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)PTHH : \(Zn+2HCl->ZnCl_2+H_2\)
---------0,3------0,6----------0,3---------0,3 ( mol )
b)Ta có nZn = 19,5/65 = 0,3 mol
Theo PTHH ta có :
nZnCl2 = 0,3 mol => mZnCl2 = 0,3.13640,8 gam
nH2 =0,3 mol => mH2 =0,3.2= 0,6 gam
c) PTHH: \(Fe_2O_3+3H_2-t^o->2Fe+3H_2O\)
ta có nFe2O3 = 128/160 = 0,8 mol
Ta có \(\dfrac{0,8}{1}>\dfrac{0,3}{3}=>Fe_2O_3dư\)
nFe2O3 dư = 0,8 - ( 0,3/3) = 0,7 mol
Khối lượng Fe2O3 dư là : 0,7.160 = 112 gam
Vậy...
a) PTHH : Zn + 2HCl \(\rightarrow\) ZnCl2 + H2 (1)
b) Có : nZn = 19,5/65 = 0,3(mol)
Theo PT(1) => nZnCl2 = nZn = 0,3(mol)
=> mZnCl2 = 0,3 . 136 = 40,8(g)
Theo PT(1) => nH2 = nZn = 0,3(mol)
=> mH2 = 0,3 . 2 = 0,6(g)
c ) Fe2O3 + 3H2 \(\underrightarrow{t^o}\) 2Fe + 3H2O (2)
Có : nFe2O3 = 128/160 = 0,8(mol)
Lập tỉ lệ
\(\dfrac{n_{Fe2O3\left(ĐB\right)}}{n_{Fe2O3\left(PT\right)}}=\dfrac{0,8}{1}=0,8\) > \(\dfrac{n_{H2\left(ĐB\right)}}{n_{H2\left(PT\right)}}=\dfrac{0,3}{3}=0,1\)
=> Sau pứ : Fe2O3 dư , H2 hết
Theo PT(2) => nFe2O3(Pứ) = 1/3 .nH2 = 1/3. 0,3 = 0,1(mol)
=> nFe2O3(dư) = 0,8 - 0,1 = 0,7(mol)
=> mFe2O3(dư) = 0,7 . 160 =112(g)

a)
\(3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4\)
b)
Ta có :
\(n_{Fe} = \dfrac{8,4}{56} = 0,15(mol)\\ n_{O_2} = \dfrac{96}{32} = 3(mol)\)
Ta thấy : \(\dfrac{n_{Fe}}{3} = 0,05 < \dfrac{n_{O_2}}{2} = 1,5\) do đó O2 dư.
Theo PTHH :
\(n_{O_2\ pư} = \dfrac{2}{3}n_{Fe} = 0,1(mol)\\ \Rightarrow n_{O_2\ dư} = 3 - 0,1 = 2,9(mol)\\ \Rightarrow m_{O_2\ dư} = 92,8(gam)\)
c)
\(n_{Fe_3O_4} = \dfrac{1}{3}n_{Fe} = 0,05(mol)\\ \Rightarrow m_{Fe_3O_4} = 0,05.232 = 11,6(gam)\)
\(a)PTHH:FeCl_3+2O_2\xrightarrow[]{t^o}Fe_3O_4\)
mol 1 2 1
mol
\(b)\)Số mol \(FeCl_3\) là: \(n_{FeCl_3}=\dfrac{m_{FeCl_3}}{M_{FeCl_3}}=\dfrac{8,4}{162,5}=0,052\left(mol\right)\)
Số mol \(O_2\) là: \(n_{O_2}=\dfrac{m_{O_2}}{M_{O_2}}=\dfrac{96}{32}=3\left(mol\right)\)
Lập tỉ lệ: \(\dfrac{1}{0,052}>\dfrac{2}{3}\Rightarrow FeCl_3dư\)
Số mol \(FeCl_3\) phản ứng là:
Từ PTHH\(\Rightarrow\) \(n_{FeCl_3}=\dfrac{0,052\times3}{3}=0,035\left(mol\right)\)
Số mol \(FeCl_3\) dư là: \(n_{FeCl_3dư}=n_{FeCl_3đầu}-n_{FeCl_3p/ứng}=0,052-0,035=0,018\left(mol\right)\)
Khối lượng \(FeCl_3\) dư là: \(m_{FeCl_3dư}=n_{FeCl_3dư}\times M_{FeCl_3}=0,018\times162,5=2,925\left(g\right)\)

nZn=19,5/65=0,3(mol)
mHCl=18,25/36,5=0,5(mol)
pt: Zn+2HCl--->ZnCl2+H2
1______2
0,3_____0,5
Ta có: 0,3/1>0,5/2
=>Zn dư
mZn dư=0,05.65=3,25(mol)
Theo pt: nH2=1/2nHCl=1/2.0,5=0,25(mol)
=>VH2=0,25.22,4=5,6(l)
nZn = 0,3 mol
nHCl = 0,5 mol
Zn + 2HCl → ZnCl2 + H2
Đặt tỉ lệ ta có
0,3 < \(\dfrac{0,52}{2}\)
⇒ Zn dư và dư 3,25 gam
⇒ VH2 = 0,25.22,4 = 5,6 (l)

a) n Fe = 5,6/56 = 0,1(mol) ; n HCl = 10,95/36,5 = 0,3(mol)
$Fe + 2HCl \to FeCl_2 + H_2$
Ta thấy :
n Fe / 1 = 0,1 < n HCl / 2 = 0,3/2 = 0,15 nên HCl dư
Theo PTHH : n HCl pư = 2n Fe = 0,2(mol)
Suy ra: m HCl dư = 10,95 - 0,2.36,5 = 3,65(gam)
b)
Theo PTHH : n FeCl2 = n H2 = n Fe = 0,1(mol)
m FeCl2 = 0,1.127 = 12,7 (gam)
m H2 = 0,1.2 = 0,2(gam)
c)
$CuO + H_2 \xrightarrow{t^o} Cu + H_2O$
n Cu = n H2 = 0,1(mol)
m Cu = 0,1.64 = 6,4(gam)

\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right);n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\\ a,PTHH:3H_2+Fe_2O_3\rightarrow\left(t^o\right)2Fe+3H_2O\\ b,Vì:\dfrac{0,4}{3}>\dfrac{0,1}{1}\Rightarrow H_2dư\\ n_{H_2\left(dư\right)}=0,4-3.0,1=0,1\left(mol\right)\\ c,Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\\ n_{FeCl_3}=2.0,1=0,2\left(mol\right)\\ m=m_{FeCl_3}=0,2.162,5=32,5\left(g\right)\)

a) \(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
\(n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
0,25 0,5 0,5 0,5
Xét tỉ lệ : \(\dfrac{0,3}{1}>\dfrac{0,5}{2}\) => Zn dư , HCl đủ
b) \(m_{Zn\left(dư\right)}=\left(0,3-0,25\right).65=3,25\left(g\right)\)
c) \(m_{ZnCl_2}=0,25.136=34\left(g\right)\)
\(V_{H_2}=0,25.22,4=5,6\left(l\right)\)
\(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\\ n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\\ a,Zn+2HCl\rightarrow ZnCl_2+H_2\\b, Vì:\dfrac{0,5}{2}< \dfrac{0,3}{1}\Rightarrow Zndư\\ n_{Zn\left(dư\right)}=0,3-\dfrac{0,5}{2}=0,05\left(mol\right)\\ \Rightarrow m_{Zn\left(dư\right)}=0,05.65=3,25\left(g\right)\\ c,n_{ZnCl_2}=n_{H_2}=\dfrac{0,5}{2}=0,25\left(mol\right)\\ \Rightarrow m_{ZnCl_2}=0,25.136=34\left(g\right)\\ V_{H_2\left(đktc\right)}=0,25.22,4=5,6\left(l\right)\)

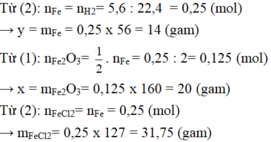
nZn = \(\dfrac{19,5}{65}\)= 0,3 mol
a) Zn + 2 HCl -> ZnCl2 + H2
1mol 2 mol 1mol 1mol
0,3 mol 0,6 mol 0,3 mol 0,3mol
b) m ZnCl2 = 136 . 0,3 = 40,8 (g)
mH2 = 2 . 0,3 = 0,6 (g)
c) nFe2O3 = \(\dfrac{128}{160}\)= 0,8 mol
3H2 + Fe2O3 -> 2Fe + 3H2O
3mol 1 mol
0,3 mol 0,1 mol
\(\dfrac{0,3}{3}\) < \(\dfrac{0,8}{1}\)
Vậy Fe2O3 dư bài toán tính theo H2
nFe2O3 dư = 0,8 - 0,1 = 0,7 (mol)
mFe2O3 dư = 160 . 0,7 = 112 (g)
nZn=m/M=19,5/65=0,3(mol)
PT:
Zn + 2HCl -> ZnCl2 +H2\(\uparrow\)
1...........2.............1............1(mol)
0,3->0,6 -> 0,3 -> 0,3 (mol)
mZnCl2=n.M=0,3.136=40,8(g)
(mH2=m.M=0,3.2=0,6(g)) ( Thưa cô,theo em nghĩ thì H2 đã bay hơi vậy có nói nó là sản phẩm không cô)
c) nFe2O3=m/M=128/160=0,8(mol)
PT:
Fe2O3 + 3H2 -> 2Fe +3H2O
1..............3...........2..............3 (mol)
0,1 <- 0,3 -> 0,2 -> 0,3(mol)
Chất dư là Fe2O3
Số mol Fe2O3 dư là : 0,8-0,1=0,7(mol)
=> mFe2O3 dư=n.M=0,7.160=112(gam)