Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) nFe= 16/56 =~ 0,3 mol
mH2S04 =( C% .mdd ) /100%= ( 20.100) /100 = 20g
nH2SO4 = 20/98 =~ 0,2mol
lập pthh của pu
Fe + H2SO4 ----------> FeSO4 + H2
1mol 1mol 1mol 1mol
0,3mol 0,2mol
xét tỉ lệ nFe dư sau pư vậy tính theo mol H2SO4
nFe (pư) = (0,2 .1 )/1 =0,2mol
nFe (dư) = 0,3 -0,2 =0,1mol
mFe dư = 0,1 . 56 = 5,6 g
mFeSO4 = 0,2 .152 = 30,4 g
b) mdd sau pư = mFe + m dung môi = 16 +100=116 g
c% Fe = (5,6 / 116) .100%=~ 4,83%
c% FeSO4 =(30,4/116).100%=~ 26,21%
a) đối 200ml =0,2 lít
CMFe =n/v = 0,1 / 0,2 =0,5 mol/lít
CMFeSO4 =n/v = 0,2/0,2=1 mol /lít

\(PTHH:Fe+CuSO_4\)→\(FeSO_4+Cu\)
\(+n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
Theo PTHH ta có:
\(+n_{Cu}=n_{Fe}=0,3\left(mol\right)\)
\(+m_{Cu}=0,3.64=19,2\left(gam\right)\)
\(+n_{CuSO_4}=n_{Fe}=0,3\left(mol\right)\)
\(+V_{CuSO_4}=0,3.0,5=0,15\left(lit\right)\)
d)
PTHH: \(2NaOH+CuSO_4\) →\(Cu\left(OH\right)_2\downarrow+Na_2SO_4\)
Cu(OH)2 làm quỳ tím chuyển màu xanh vì là bazo.

Ta có: \(n_{CuSO_4}=0,3\left(mol\right)\)
a, PT: \(2Al+3CuSO_4\rightarrow Al_2\left(SO_4\right)_3+3Cu\)
______0,2____0,3_________________0,3 (mol)
b, \(m_{Al}=0,2.27=5,4\left(g\right)\)
c, \(m_{Cu}=0,3.64=19,2\left(g\right)\)
Bạn tham khảo nhé!

\(n_{CuSO_4}=\dfrac{200.8}{100.160}=0,1(mol)\\ PTHH:Fe+CuSO_4\to FeSO_4+Cu\\ a,n_{Cu}=n_{Fe}=n_{CuSO_4}=0,1(mol)\\ \Rightarrow m_{Cu}=0,1.64=6,4(g);m_{Fe}=0,1.56=5,6(g)\\ b,n_{FeSO_4}=0,1(mol)\\ \Rightarrow C\%_{FeSO_4}=\dfrac{0,1.152}{5,6+200-6,4}.100\%=7,63\%\)

Khối lượng dung dịch CuSO 4 : m dd CuSO 4 = 1,12 x 50 = 56 (gam).
CuSO 4 + Fe → FeSO 4 + Cu
64x — 56x = 5,16 - 5 = 0,16 (gam) => x = 0,02 mol.
m CuSO 4 tham gia phản ứng = 0,02 x 160 = 3,2 (gam);
100 gam dung dịch CuSO 4 có 15 gam CuSO 4 nguyên chất.
56 gam dung dịch CuSO 4 có X gam CuSO 4 nguyên chất.
x = 56 x 15/100 = 8,4g; m CuSO 4 còn lại = 8,4 - 3,2 = 5,2g
m FeSO 4 = 0,02 x 152 = 3,04g
m dd sau p / u = 56 - 0,16 = 55,84g
C % CuSO 4 = 5,2/55,84 x 100% = 9,31%
C % FeSO 4 = 3,04/55,84 x 100% = 5,44%
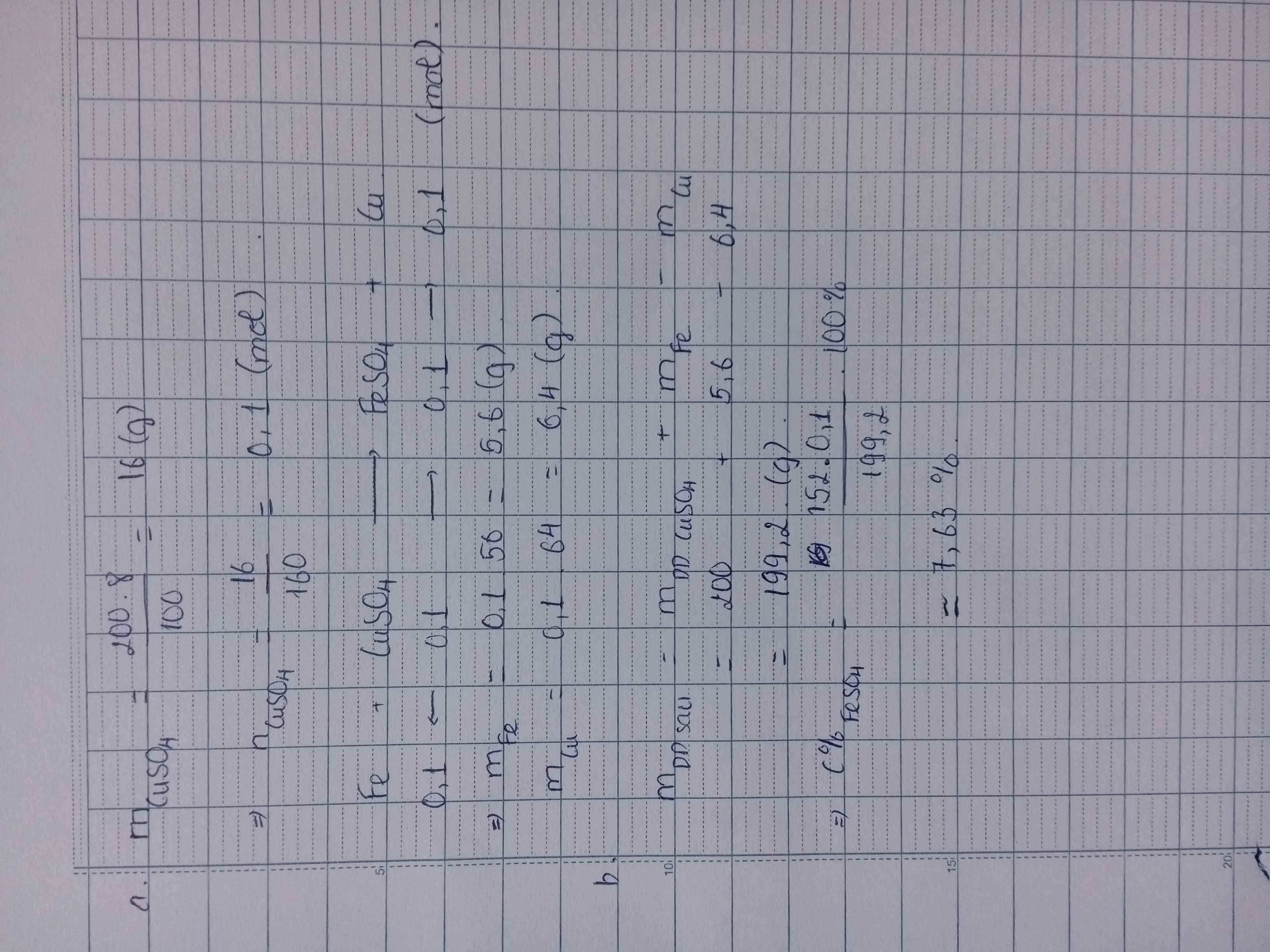

\(n_{Fe}=\frac{16,8}{56}=0,3\left(mol\right);n_{CuSO4}=\frac{16\%\cdot400}{100\%\cdot160}=0,4\left(mol\right).\\ PTHH:\\ Fe+CuSO4-->Cu+FeSO4.\\ Lậptỉlệ:\frac{n_{Fe}}{1}=\frac{0,3}{1}< \frac{n_{CuSO4}}{1}=\frac{0,4}{1}\)
=> Fe hết, CuSO4 dư
Lại có: nFe= nCu=> mCu = 0,3. 64=19,2 (g)
Không chắc lắm vì mình không biết có phải tính Cu trong CuSO4 dư không nữa @.@ Xin lỗi ạ!
b, Ta có: \(\left\{{}\begin{matrix}n_{CuSO4dư}=0,4-0,3=0,1\left(mol\right)\\n_{FeSO4}=0,3\left(mol\right)\end{matrix}\right.\)
mdd = mFe+ mddCuSO4 = 16,8+400 = 416,8(g)
C%(dd FeSO4) \(=\frac{0,3\cdot152}{416,8}\cdot100\%\approx10,940\%\)
C%(dd CuSO4 dư) \(=\frac{0,1\cdot160}{416,8}\cdot100\%\approx3,839\%\)
Fe+CuSO4--->Cu+FeSO4
n\(_{Fe}=\frac{16,8}{56}=0,3\left(mol\right)\)
n\(_{CuSO4}=\frac{400.16}{100.160}=0,4\left(mol\right)\)
=> CuSO4 dư
a) Theo pthh
n\(_{Cu}=n_{Fe}=0,3\left(mol\right)\)
m\(_{Cu}=0,3.64=19,2\left(g\right)\)
b) m dd sau pư= 400+16,8=416,8(g)
C% CuSO4 dư=\(\frac{0,1.160}{416,8}.100\%=3,84\%\)
C% FeSO4 =\(\frac{0,3.152}{416,8}.100\%=10,94\%\)