Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2SO_4}=n_{H_2}=a(mol)\\ BTKL:\\ m_{hh}+m_{H_2SO_4}=m_{muối}+m_{H_2}\\ 29+98.a=86,6+2.a\\ \to a=0,6(mol)\\ V_{H_2}=0,6.22,4=13,44(l)\)

- Cho 4,95 (g) R pư với HCl, thấy kim loại dư.
Ta có: \(n_{HCl}=\dfrac{5,475}{36,5}=0,15\left(mol\right)\)
PT: \(R+2HCl\rightarrow RCl_2+H_2\)
\(n_{R\left(pư\right)}=\dfrac{1}{2}n_{HCl}=0,075\left(mol\right)\)
\(n_{R\left(banđau\right)}>0,075\Rightarrow\dfrac{4,95}{M_R}>0,075\Rightarrow M_R< 66\left(g/mol\right)\) (1)
- Cho 18,6 (g) hh Fe và R pư với H2SO4 dư.
PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(R+H_2SO_4\rightarrow RSO_4+H_2\)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(n_{hh}=n_{Fe}+n_R=n_{H_2}=0,3\left(mol\right)\)
\(\Rightarrow\overline{M_{hh}}=\dfrac{18,6}{0,3}=62\left(g/mol\right)\)
Mà: MFe < 62 (g/mol) → MR > 62 (g/mol) (2)
Từ (1) và (2) ⇒ 62 < MR < 66
→ R là Zn (65 g/mol)

\(1.\\ n_A=\dfrac{16,8}{A}mol\\ n_{H_2}=\dfrac{7,437}{24,79}=0,3mol\\ A+2HCl\rightarrow ACl_2+H_2\\ \Rightarrow\dfrac{16,8}{A}=0,3\\ \Rightarrow A=56g/mol\\ \Rightarrow A.là.Fe\\ \Rightarrow Chọn.A\\ 2.\\ n_{Fe}=\dfrac{5,6}{56}=0,1mol\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ n_{Fe}=n_{H_2}=0,1mol\\ V_{H_2}=0,1.24,79=2,479l\\ \Rightarrow Chọn.B\\ 3.\\ Axit:H_2SO_4;HCl\\ \Rightarrow Chọn.B\\ 4.\\ 3,719l\Rightarrow3,7185\\ CTHH:R\\ n_R=\dfrac{3,6}{R}mol\\ n_{H_2}=\dfrac{3,7185}{24,79}=0,15mol\\ R+2HCl\rightarrow RCl_2+H_2\\ \Rightarrow\dfrac{3,6}{R}=0,15\\ \Rightarrow R=24g/mol,Mg\\ \Rightarrow Chọn.B\)

\(\left\{{}\begin{matrix}Mg\\Zn\\Fe\end{matrix}\right.+H_2SO_4\rightarrow\left\{{}\begin{matrix}MgSO_4\\ZnSO_4\\FeSO_4\end{matrix}\right.+H_2\uparrow\)
\(m_{SO_4}=86,8-29=57,8\left(g\right)\)
\(\Rightarrow n_{H_2}=n_{H_2SO_4}=n_{SO_4}=0,6\left(mol\right)\)
\(\Rightarrow b=V_{H_2}=0,6.22,4=13,44\left(l\right)\)

Gọi nAl=a; nR=b→ 27a+ Rb= 1,93.
(Từ số mol H2 → R có PƯ với H2SO4).
Al(0)→ Al(+3) +3 e
a_____a______3a
R(0)→ R(+x) +x e
b_____b______xb
R(0)→ R(+y) +y e
b_____b______yb
Giả thiết: nH2= 1,456/22,4= 0,065; nNO2= 3,36/22,4= 0,15
2H(+1) +2e→ H2
0,13___0,13__0,13
N(+5) +1e→ N(+4)
0,15___0,15__0,15
ÁDĐLBT e:
TN1: 3a+ xb= 0,13
TN2: 3a+ yb= 0,15
→ b= 0,02/(y-x) → y>x.
Xét các TH x=2; y=3 và x=1; y=2 ta có:
+ x=2; y=3→a=0,03; b=0,02 → R= 56 (Fe).
+ x=1; y=2→a=11/300; b=0.02→ R=47 ( loại)
Vậy chọn A.Fe
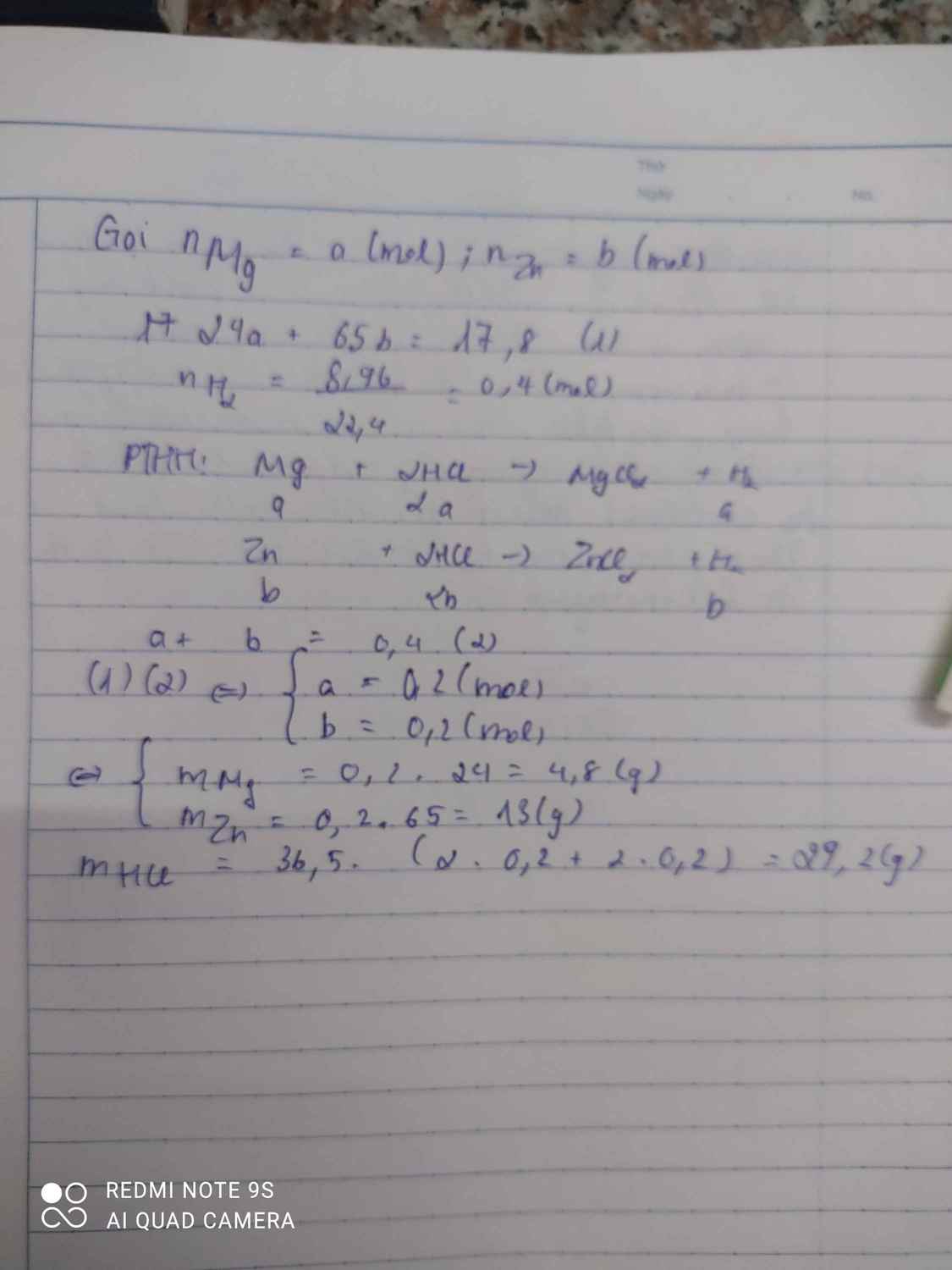
2R+2xHCl---->2RClx+xH2
n H2=5,376/22,4=0,24(mol)
n R=2/x n H2=0,48/x(g)
M R=15,6: 0,48/x=32,5x(đề là 15,6 thì hợp lý hơn ấy ạ)
+x=2--->R=65(Zn)
Vậy R là kẽm
Cho 1,56 gam kim loại R tác dụng vs dung dịch HCl dư, sau phản ứng xảy ra hoàn toàn thu được 5,376 lít H2 (đktc). Kim loại R là:
A. Mg B. Al C. Fe D. Zn