Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2 0,6 0,2 0,3
a)\(V_{H_2}=0,3\cdot22,4=6,72l\)
b)\(C_{M_{HCl}}=\dfrac{0,6}{0,15}=4M\)
d)\(n_{PbO}=\dfrac{66,9}{207+16}=0,3mol\)
\(PbO+H_2\rightarrow Pb+H_2O\)
0,3 0,3 0,3
\(m_{kl}=m_{Pb}=0,3\cdot207=62,1g\)

a) Zn + 2HCl --> ZnCl2 + H2
b) \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,2--------------------->0,2
=> VH2 = 0,2.22,4 = 4,48 (l)
c) \(n_{CuO}=\dfrac{24}{80}=0,3\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,2}{1}\) => CuO dư, H2 hết
PTHH: CuO + H2 --to--> Cu + H2O
0,2<--0,2-------->0,2
=> nCuO(dư) = 0,3 - 0,2 = 0,1 (mol)
mCu = 0,2.64 = 12,8 (g)

a, \(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}=0,15\left(mol\right)\Rightarrow V_{H_2}=0,15.22,4=3,36\left(l\right)\)
b, Có lẽ đề hỏi bao nhiêu gam đồng thay vì "bao nhiêu gam sắt" bạn nhỉ?
\(n_{CuO}=\dfrac{20}{80}=0,25\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,25}{1}>\dfrac{0,15}{1}\), ta được CuO dư.
Theo PT: \(n_{Cu}=n_{H_2}=0,15\left(mol\right)\Rightarrow m_{Cu}=0,15.64=9,6\left(g\right)\)

a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, Ta có: \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,1\left(mol\right)\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c, PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Theo PT: \(n_{Fe}=\dfrac{2}{3}n_{H_2}=\dfrac{1}{15}\left(mol\right)\Rightarrow m_{Fe}=\dfrac{1}{15}.56=\dfrac{56}{15}\left(g\right)\)

Zn+2Hcl->ZnCl2+H2
0,2---0,4----0,2----0,2
n Zn=0,2 mol
=>VH2 =0,2.22,4=4,48l
mZncl2=0,2.136=27,2g
3H2+Fe2O3-to>2Fe+3H2O
0,2---------------------2\15
->m Fe=2\15.56=7,467g
nZn= 13/65=0,2(mol)
a) PTHH: Zn + 2 HCl -> ZnCl2 + H2
b) nH2=nZnCl2=nZn=0,2(mol)
=>V(H2,đktc)=0,2 x 22,4= 4,48(l)
c) khối lượng muối sau phản ứng chứ nhỉ?
mZnCl2=136.0,2=27,2(g)

\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,2------------------>0,2
=> nH2(dùng để khử) = 0,4 (mol)
PTHH: PbO + H2 --to--> Pb + H2O
0,4------->0,4
=> mPb = 0,4.207 = 82,8 (g)

a.b.c.\(n_{Al}=\dfrac{2,7}{27}=0,1mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,1 0,1 0,15 ( mol )
\(V_{H_2}=0,15.22,4=3,36l\)
\(m_{AlCl_3}=0,1.133,5=13,35g\)
d.\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,15 0,1 ( mol )
\(m_{Fe}=0,1.56=5,6g\)

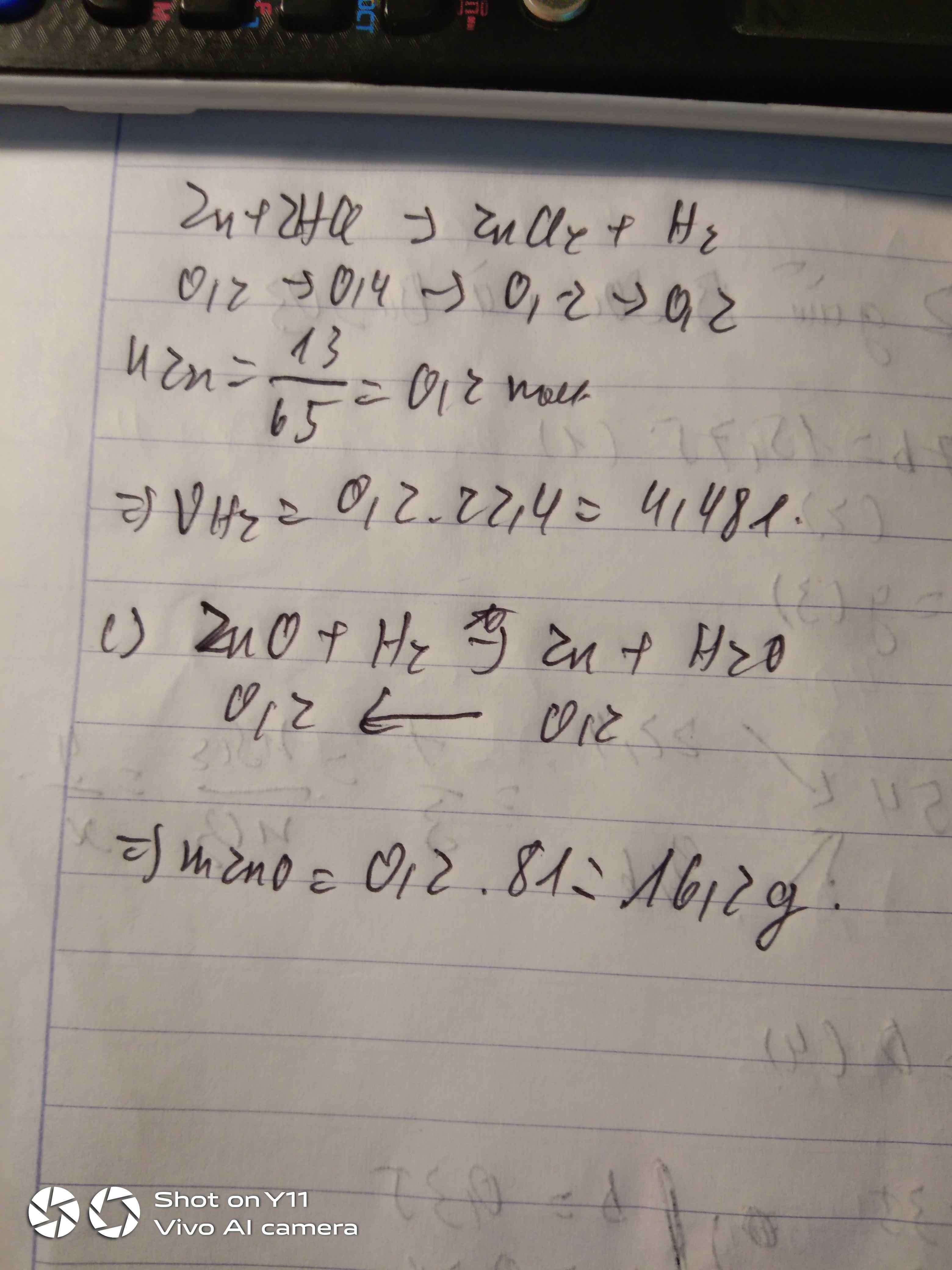
`Zn + 2HCl -> ZnCl_2 + H_2`
`0,2` `0,4` `0,2` `0,2` `(mol)`
`n_[Zn]=13/65=0,2(mol)`
`a)V_[H_2]=0,2.22,4=4,48(l)`
`b)C%_[HCl]=[0,4.36,5]/100 . 100 =14,6%`
`c)C%_[ZnCl_2]=[0,2.136]/[13+100-0,2.2].100~~24,16%`
`d)`
`H_2 + CuO` $\xrightarrow{t^o}$ `Cu + H_2 O`
`0,1` `0,1` `0,1` `(mol)`
`n_[CuO]=8/80=0,1(mol)`
Ta có:`[0,2]/1 > [0,1]/1`
`=>H_2` dư, `CuO` hết
`=>m_[Cu]=0,1.64=6,4(g)`
\(n_{Zn}=\dfrac{13}{65}=0,2mol\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
0,2 0,2 0,2 0,2
a)\(V_{H_2}=0,2\cdot22,4=4,48l\)
b)\(m_{H_2SO_4}=0,2\cdot98=19,6g\)
\(C\%=\dfrac{m_{ct}}{m_{dd}}\cdot100\%=\dfrac{19,6}{100}\cdot100\%=19,6\%\)
c)\(m_{ZnSO_4}=0,2\cdot161=32,2g\)
\(m_{ddZnSO_4}=13+100-0,2\cdot2=112,6g\)
\(C\%=\dfrac{m_{ct}}{m_{dd}}\cdot100\%=\dfrac{32,2}{112,6}\cdot100\%=28,6\%\)
d)\(n_{CuO}=\dfrac{8}{80}=0,1mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
0,1 0,2 0,1
\(m_{Cu}=0,1\cdot64=6,4g\)