Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Cu+HCl\rightarrow\)(không phản ứng)
2Al + 6HCl => 2AlCl3 + 3H2
0,3/3*2 (6,72/22,4)
=> mAl = 0,2 *27 =5,4g; mCu = 11,8 - 5,4 = 6,4g

\(a)2Al+HCl\rightarrow2AlCl_3+3H_2\\ Fe+2HCl\rightarrow FeCl_2+H_2\)
b) \(n_{HCl}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\\ Gọi:n_{Al}=x\left(mol\right);n_{Fe}=y\left(mol\right)\\ Tacó:\left\{{}\begin{matrix}27x+56y=m_{hh}\\\dfrac{3}{2}x+y=0,4\end{matrix}\right.\)
Đề thiếu dữ kiện, xem lại đề nha bạn !

PTHH:
Fe + 2HCl -> FeCl2 + H2
b b
Mg + 2HCl -> MgCl2 + H2
a a
=> Ta có: 24a + 56a = 3,68 ; ( a + b ) x 22,4 = 2,24
=> a = 0,06 b = 0,04
Khối lượng của Mg có trong hỗn hợp là: m = M . n = 0,06 x 24 = 1,14 ( g )
Thành phần phần trăm theo khối lượng của Mg trong hỗn hợp là: 1,14 x 100 / 3,68= 39,1 %
Thành phần phần trăm theo khối lượng của Fe trong hỗn hợp là: 100% - 39,1% = 60,9%

a, Ta có: 65nZn + 27nAl = 11,9 (1)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Theo PT: \(n_{H_2}=n_{Zn}+\dfrac{3}{2}n_{Al}=\dfrac{9,916}{24,79}=0,4\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Zn}=0,1\left(mol\right)\\n_{Al}=0,2\left(mol\right)\end{matrix}\right.\)
⇒ mZn = 0,1.65 = 6,5 (g)
mAl = 0,2.27 = 5,4 (g)
b, Theo PT: nZnCl2 = nZn = 0,1 (mol)
nAlCl3 = nAl = 0,2 (mol)
⇒ m muối = 0,1.136 + 0,2.133,5 = 40,3 (g)
c, Theo PT: nHCl = 2nH2 = 0,8 (mol)
\(\Rightarrow m_{ddHCl}=\dfrac{0,8.36,5}{10\%}=292\left(g\right)\)

\(a,n_{H_2}=\dfrac{3,36}{22,4}=0,15(mol)\\ PTHH:Fe+2HCl\to FeCl_2+H_2\\ \Rightarrow n_{Fe}=n_{H_2}=0,15(mol)\\ \Rightarrow m_{Fe}=0,15.56=8,4(g)\\ \Rightarrow \%_{Fe}=\dfrac{8,4}{15}.100\%=56\%\\ \Rightarrow \%_{Cu}=100\%-56\%=44\%\\ b,n_{HCl}=2n_{H_2}=0,3(mol)\\ \Rightarrow C_{M_{HCl}}=\dfrac{0,3}{0,1}=3M\)


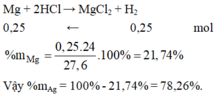
Mg+2HCl--->MgCl2+H2
2A+6HCl---->2AlCl3+3H2
Al+2NaOH+H2O ---->2NaAlO2+2H2
n \(_{H2}\)ở pt3 = \(\frac{6,72}{22,4}=0,3\left(mol\right)\)
Theo pthh3
n\(_{Al}=\frac{1}{2}n_{H2}=0,15\left(mol\right)\)
m\(_{Al}=0,15.27=4,05\left(g\right)\)
n\(_{H2}\) ở pt 1 và2=\(\)\(\frac{8,96}{22,4}=0,4\left(mol\right)\)
mà Theo pthh2
n\(_{H2}=\frac{3}{2}n_{Al}=0,225\left(mol\right)\)
--->n\(_{H2}ở\)pt 1= 0,4-0,225=0,175(mol)
Theo pthh1
n\(_{Mg}=n_{H2}=0,175\left(mol\right)\)
m\(_{Mg}=0,175.24=4,2\left(g\right)\)
m hh=4,2+4,05=8,25(g)
%m\(_{Mg}=\frac{4,2}{8,25}.100\%=50,91\%\)
%m\(_{Al}=100-50,91=49,09\%\)
Gọi số mol Mg, Al là a b mol
\(\text{Ta có Mg+2HCl}\rightarrow\text{MgCl2+H2(1)}\)
\(\text{2Al+6HCl=2AlCl3+3H2}\)
\(\text{nH2=0,4mol }\)
=>a+1,5b=0,4.
\(\text{2Al+2NaOH+2H2O=2NaAlO2+3H2.}\)
nH2=0,3mol
=> nAl=b=0,2mol.
=>a=0,1(mol)
\(\Rightarrow\text{%Mg=0,1x24/(0,1x24+0,2x27)x100=30,77%}\)
\(\Rightarrow\text{%Al=100-30,77=69,23%}\)