Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H2}=\frac{15,68}{22,4}=0,7\left(mol\right)\)
\(40n_{Ca}+137n_{Ba}=66,8\)
\(2n_{Ca}+2n_{Ba}=2n_{H2}=0,7.2=1,4\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Ca}=0,3\\n_{Ba}=0,4\end{matrix}\right.\)
\(\%m_{Ca}=\frac{0,3.40}{66,8}.100\%=17,96\%\)
\(\%m_{Ba}=100\%-17,96\%=82,04\%\)
\(n_{HCl}=\frac{45,625}{36,5}=1,25\left(mol\right)\)
\(n_{H2}=\frac{11,76}{22,4}=0,525\left(mol\right)\)
\(Fe_xO_y+yH_2\rightarrow xFe+yH_2O\)
0,7/y____0,7_______________
\(Fe_xO_y+2HCl\rightarrow FeCl_2+H_2\)
0,1/y____0,2_______________
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,525__1,05______________0,525
\(n_{FexOy.ban.dau}=\frac{0,7}{y}+\frac{0,1}{y}=\frac{0,8}{y}\)
\(\Rightarrow M_{FexOy}=\frac{46,4}{\frac{0,8}{y}}\)
\(\Rightarrow56x+16y=58y\)
\(\Rightarrow56x=42y\Rightarrow\frac{x}{y}=\frac{42}{56}\)
\(\Rightarrow\frac{x}{y}=\frac{3}{4}\)
Vậy CTHH của oxit là Fe3O4

3) Gọi CTPT của oxit đó là A2Ox
Ptpư: A2Ox + 2xHCl = 2AClx + xH2O
(2A + 16x)g (2A + 71x)g
5,6g 11,1g
Ta có: A = 20x
n A
1 20
2 40
3 60
4 80
Vậy A chỉ có thể là canxi.
2) Phương trình phản ứng; Gọi kim loại là A; khối lượng phân tử M; n là hoá trị của A với OH
A + nH2O = A(OH)n + n/2 H2
Mol H2 = 0,168/22,4 = 0,0075 mol => mol A = 0,015/n
mà mol của A cũng bằng 0,3/M
Giải phương trình:
0,3/M = 0,015/n biết hoá trị tối đa là 3; nghĩa là n=1 => M=20
n=2 => M=40
n=3 => M=60
Chỉ có giá trị n=2 và M=40 thoả mãn => kim loại đó là Ca

a,
\(CuO+H_2\underrightarrow{^{to}}Cu+H_2O\)
\(Fe_xO_y+yH_2\underrightarrow{^{to}}xFe+yH_2O\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
b,
mgiảm =\(54,4-40=14,4\left(g\right)=m_O\Rightarrow n_O=0,9\left(mol\right)\)
\(H_2+O\rightarrow H_2O\)
____0,9___0,9
\(\Rightarrow m=m_{H2O}=16,2\left(g\right)\)
\(n_{H2}=\frac{13,44}{22,4}=0,6\left(mol\right)\)
\(\Rightarrow n_{Fe}=0,6\left(mol\right)\)
\(m_{Fe}=33,6\left(g\right)\Rightarrow m_{Cu}=6,4\left(g\right)\)
\(\Rightarrow n_{Cu}=n_{O\left(CuO\right)}=0,1\left(mol\right)\)
\(\Rightarrow n_{O\left(FexOy\right)}=0,9-0,1=0,8\left(mol\right)\)
\(n_{Fe}:n_O=0,6+0,8=3:4\Rightarrow Fe_3O_4\)

nH2= 0,448/22,4= 0,02(mol)
PTHH :
CuO + H2 -tdo--> Cu + H20
FexOy + yH2 -tdo-> xFe + yH20
Cu + HCl --> k pu
Fe + 2HCl ---> FeCl2 + H2
0,02 -- 0,04---> 0,02 --- 0,02 (mol)
mFe = 0,02 .56= 1,12(g)
=> mCu = 1,76 - 1,12= 0,64(g)
n Cu = 0,64 /64 =0,01(mol)
PTHH :
CuO + H2 -tdo-> Cu + H20
0,,01 --0,01 ----> 0,01(mol)
mCuO= 0,01 . 80 = 0,8(g)
=> mFexOy = 2,4-0,8= 1,6(g)
PTHH :
FexOy + yH2 ---> xFe + yH20
56x+ 16y ---------> 56x
1,6 (g) -------------> 1,12(g)
<=> 1,6 .56x = 1,12( 56x + 16y)
<=> 89,6x = 62,72 x + 17,92y
<=> 89,6x - 62,72x = 17,92y
<=> 26,88 x = 17,92y
=> x/y= 17,92 / 26,88 =2/3
Vậy công thức đúng là Fe203.

a/ Vì sau phản ứng thu được 2 chất rắn nên H2 phản ứng hết
\(n_{H_2}=\frac{8,961}{22,4}\approx0,4\left(mol\right)\)
\(\Rightarrow m_{H_2}=0,4.2=0,8\left(g\right)\)
Theo định luật bảo toàn khối lượng thì:
\(m=7,2+28,4-0,8=34,8\left(g\right)\)
b/ \(Fe_xO_y+yH_2\left(\frac{0,3y}{x}\right)\rightarrow xFe\left(0,3\right)+yH_2O\)
\(Fe\left(0,3\right)+2HCl\rightarrow FeCl_2+H_2\left(0,3\right)\)
\(n_{H_2}=\frac{6,72}{22,4}=0,3\left(mol\right)\)
\(\Rightarrow\frac{0,3y}{x}=0,4\)
\(\Rightarrow\frac{y}{x}=\frac{0,4}{0,3}=\frac{4}{3}\)
Vậy oxit đó là Fe3O4

Phương trình phản ứng:
FE+2HCL->Fecl2+H2
Số mol H2 = 0,896/22,4 = 0,04 mol => Mol Fe = 0,04 mol => Số g Cu = 3,52 - 56x0,04 = 1,28
=> Khối lượng CuO trong hỗn hợp ban đầu = (1,28/64)x(64+16) = 1,6g => Số g oxit sắt = 4,8-1,6 = 3,2g.
Gọi công thức của oxit sắt là: FexOy.
Ta có số mol của oxit sắt:32/(56x+16y) = 0,04/x
Giải ra ta được tỉ lệ x/y = 2/3 => Công thức phân tử của oxit sắt là: Fe2O3
Gọi CTHH của oxit sắt là: FexOy
PTHH: CuO + H2 -> Cu + H2O (1)
FexOy + H2 -> xFe + H2O (2)
Fe + HCl -> FeCl2 + H2 (3)
(Chất rắn thu được sau phản ứng là Cu và Fe nhưng Cu ko tác dụng được vs HCl nên chỉ có Fe)
nH2 (ĐKTC) \(\frac{0,896}{22,4}=0,04\left(mol\right)\)
nFe = nH2 = 0,04 mol => mFe = 0,04 . 56 = 2,24 (g)
mCu = 3,52 - 2,24 = 1,28 (g)
mCuO trong hỗn hợp b.đầu: \(\frac{1.28}{64}.80=1,6\left(g\right)\)
mFexOy = 4,8 - 1,6 = 3,2 (g)
nFexOy = \(\frac{3,2}{56x+16y}=\frac{0,04}{x}\)
=> \(\frac{x}{y}=\frac{3}{4}\)
=> CTHH của oxit sắt là: Fe3O4
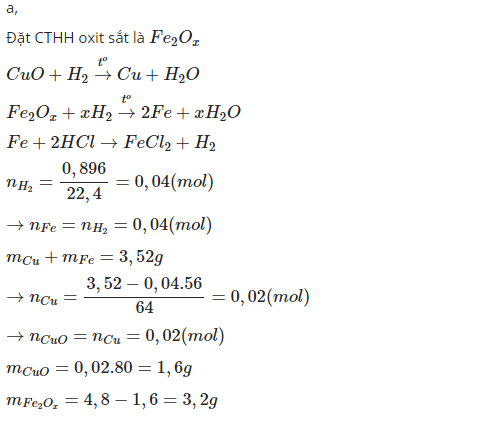
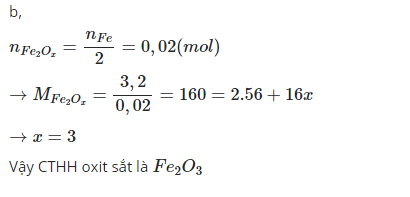
a)
Gọi \(\left\{{}\begin{matrix}n_{CuO}=a\left(mol\right)\\n_{Fe_xO_y}=b\left(mol\right)\end{matrix}\right.\)
=> 80a + b(56x + 16y) = 4,8 (1)
PTHH: CuO + H2 --to--> Cu + H2O
a------------->a
FexOy + yH2 --to--> xFe + yH2O
b----------------->bx
=> 64a + 56bx = 3,52 (2)
PTHH: Fe + 2HCl --> FeCl2 + H2
bx-------------------->bx
=> \(bx=\dfrac{0,892}{22,4}\approx0,04\left(mol\right)\)
(2) => a = 0,02 (mol)
(1) => by = 0,06
Xét \(\dfrac{bx}{by}=\dfrac{x}{y}=\dfrac{0,04}{0,06}=\dfrac{2}{3}\)
=> CTPT: Fe2O3
=> b = 0,02 (mol)
\(\left\{{}\begin{matrix}m_{CuO}=0,02.80=1,6\left(g\right)\\m_{Fe_2O_3}=0,02.160=3,2\left(g\right)\end{matrix}\right.\)
b) CTPT: Fe2O3