Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có nAgNO3 = 0,02 mol => nAg tối đa được sinh ra = 0,02 mol
=> mAg tối đa sinh ra = 2,16 g < 2,2915g => có kim loại Cu dư: 0,1315g
Gọi x là số mol Zn và y là số mol Cu pứ.
ta có 65x + 64y = 0,774 - 0,1315.
và 2x + 2y = 0,02. 1 (bảo toàn e)
=> x= 0,0025 => mZn = 0,1625g

Đáp án A
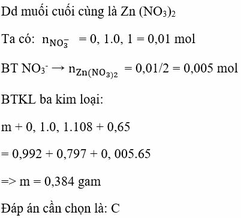
nZn = 0,06 mol > ½ nNO3
=> Zn dư , dung dịch muối Y chỉ có Zn(NO3)2 với số mol là 0,04 mol
Bảo toàn khối lượng :
mZn + mY = mZn(NO3)2 + mrắn => my = 9,8g
Và : mCu + mAgNO3 = mX + mY
=> mCu = m = 3,2g

Đáp án C
Ta có: ![]()
Ta có: ![]()
Bảo toàn điện tích:

Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL:
Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL: ![]()
![]()

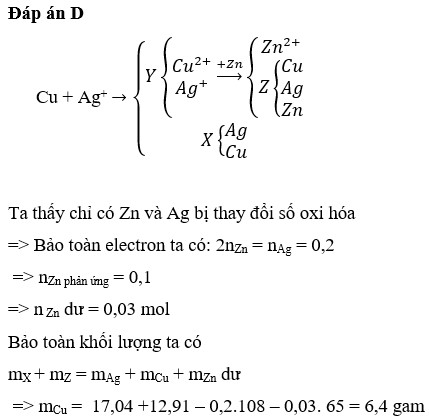
Đáp án D
nAgNO3 = 0,036 mol
nCu(NO3)2 = 0,024 mol
Xét cả quá trình phản ứng, ta thấy chỉ có Mg nhường e và Ag+, Cu2+ nhận e.
Bte: 2nMg pư = nAg+ + 2nCu2+ => nMg pư = (0,036 + 2.0,024):2 = 0,042 mol
=> nMg dư = 0,08 – 0,042 = 0,038 mol
Ta có: mX + mY = m + mAg + mCu + mMg dư => 4,21 + 4,826 = m + 0,036.108 + 0,024.64 + 0,038.24
=> m = 2,7 gam



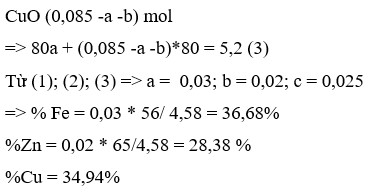
Số mol hh A (Zn,Cu) nằm trong khoảng:
\(\frac{0,774}{65}< n_A< \frac{0,774}{64}\Leftrightarrow0,0119< n_A< 0,121\)
Mà: \(n_{Ag+}=0,5\cdot0,04=0,02\left(mol\right)< 2n_A\)
Hai kim loại trong hh A đều hóa trị 2 và cùng phản ứng với Ag+ nên chắc chắn Ag+ hết, hh A dư!
Khối lượng bạc sinh ra tối đa là: \(m_{Ag\downarrow max}=0,02\cdot108=2,16\left(g\right)\)
Trong rắn X gồm 2,16 g Ag và 1 phần hh A dư (nặng 2,288-2,16=0,128g)
Khối lượng hhA phản ứng là: 0,774-0,128=0,646(g)
Nhận thấy \(\frac{0,646}{0,02:2}=64,6\) suy ra trong hhA phản ứng có cả Zn và Cu
Mà theo dãy điện hóa thì Zn phản ứng hết mới đến lượt Cu phản ứng nên Zn chắc chắn hết!
Vậy hh rắn X gồm Ag và Cu dư.
do phản ứng xảy ra có chất phản ứng là Zn, Cu, Ag nên chất sản phẩm có Zn, Cu, Ag . Vậy đáp án là C, đúng thì tích