Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nAl(OH)3=\(\dfrac{23.4}{78}\)=0.3(mol)
nNaOH=0.2*2=0.4(mol)
Al(OH)3+NaOH---->NaAlO2+2H2O
mol:\(\dfrac{0.3}{1}\)<\(\dfrac{0.4}{1}\) => NaOH dư
Al(OH)3+NaOH---->NaAlO2+2H2O
mol:0.3--->0.3--------->0.3 (mol)
mNaAlO2=82*0.3=24.6(g)
nNaOH dư=0.4-0.3=0.1(mol)
mNaOH thu được=40*0.1=4(g)

Đáp án B
Na2O+ H2O→ 2NaOH
0,02 0,02+0,02
NaOH+ HCl→ NaCl + H2O
0,02 0,02
2NaOH dư+ H2SO4→ Na2SO4+ 2H2O
0,02 0,01
Do đó a=mNa2O= 0,02.62= 1,24 gam

Trong 200 ml dung dịch E:
\(n_{Al^{3+}}=n_{AlCl_3}+2n_{Al_2\left(SO_4\right)_3}=0,2x+0,4y\) (mol)
\(n_{OH^-}=n_{NaOH}=0,7mol\)
+ E + NaOH: \(n_{Al\left(OH\right)_3}=\dfrac{7,8}{78}=0,1mol\)
\(Al^{3+}+3OH^-\rightarrow Al\left(OH\right)_3\downarrow\)
0,1<-----0,3<----------0,1
\(Al^{3+}+4OH^-\rightarrow\left[Al\left(OH\right)_4\right]^-\)
0,1<-----------0,4
\(\Rightarrow n_{Al^{3+}}=0,1+0,1=0,2mol\) \(\Rightarrow0,2x+0,4y=0,2\) (1)
+ E + BaCl2 dư: \(n_{BaSO_4}=\dfrac{27,96}{233}=0,12mol\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\downarrow\)
.............0,12<------0,12
\(\Rightarrow n_{SO_4^{2-}}=3n_{Al_2\left(SO_4\right)_3}=3.0,2.y=0,12\)
\(\Rightarrow y=0,2\text{mol/lít}\) , thay vào (1) được \(x=0,6\text{mol/lít}\)
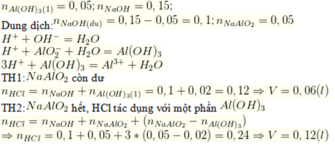
$n_{Al(OH)_3} = 0,05(mo)$
$NaOH + HCl \to NaCl + H_2O$
TH1 : Axit dư
$3HCl + Al(OH)_3 \to AlCl_3 + 3H_2O$
Theo PTHH :
$n_{HCl} = 0,2a + 0,05.3 = 0,1 \Rightarrow a = -0,25 <0 \to$ Loại
TH2 : NaOH dư
$NaOH + Al(OH)_3 \to NaAlO_2 + 2H_2O$
Ta có :
$n_{NaOH} = 0,1 + 0,05 =0,15(mol) \Rightarrow a = \dfrac{0,15}{0,2} = 0,3M$