Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Quy tắc hóa trị với hợp chất hai nguyên tố: Trong công thức hóa học, tích của chỉ số và hóa trị của nguyên tố này bằng tích của chỉ số và hóa trị của nguyên tố kia.
VD theo bài 2 ta có :
FeO : Fe hóa trị II, oxi cũng hóa trị II ⇒ II.1 = 1.II
SiO2 : Si hóa trị IV, oxi hóa trị II ⇒ IV .1 = II. 2
b) Vì K hóa trị I, nhóm SO4 hóa trị II
Theo quy tắc hóa trị: 2 x I = 1 x II.
⇒ Công thức K2SO4 là công thức phù hợp với quy tắc hóa trị.

vì đây là pứ với chất oxi hóa mạnh và có nhiệt độ cao nên P phải nên hóa trị cao nhất nhé , muốn P lên hóa trị 3 cần cho oxi thiếu thì sẽ đc nha

mNACl=200.2%+300.5%=19(g)
C%=\(\dfrac{19}{200+300}.100\%=0,18\%\)
\(m_{ddNaOH\left(sau\right)}=200+300=500\left(g\right)\\ m_{NaOH}=200.2\%+300.5\%=19\left(g\right)\\ C\%_{ddNaOH}=\dfrac{19}{500}.100=3,8\%\)

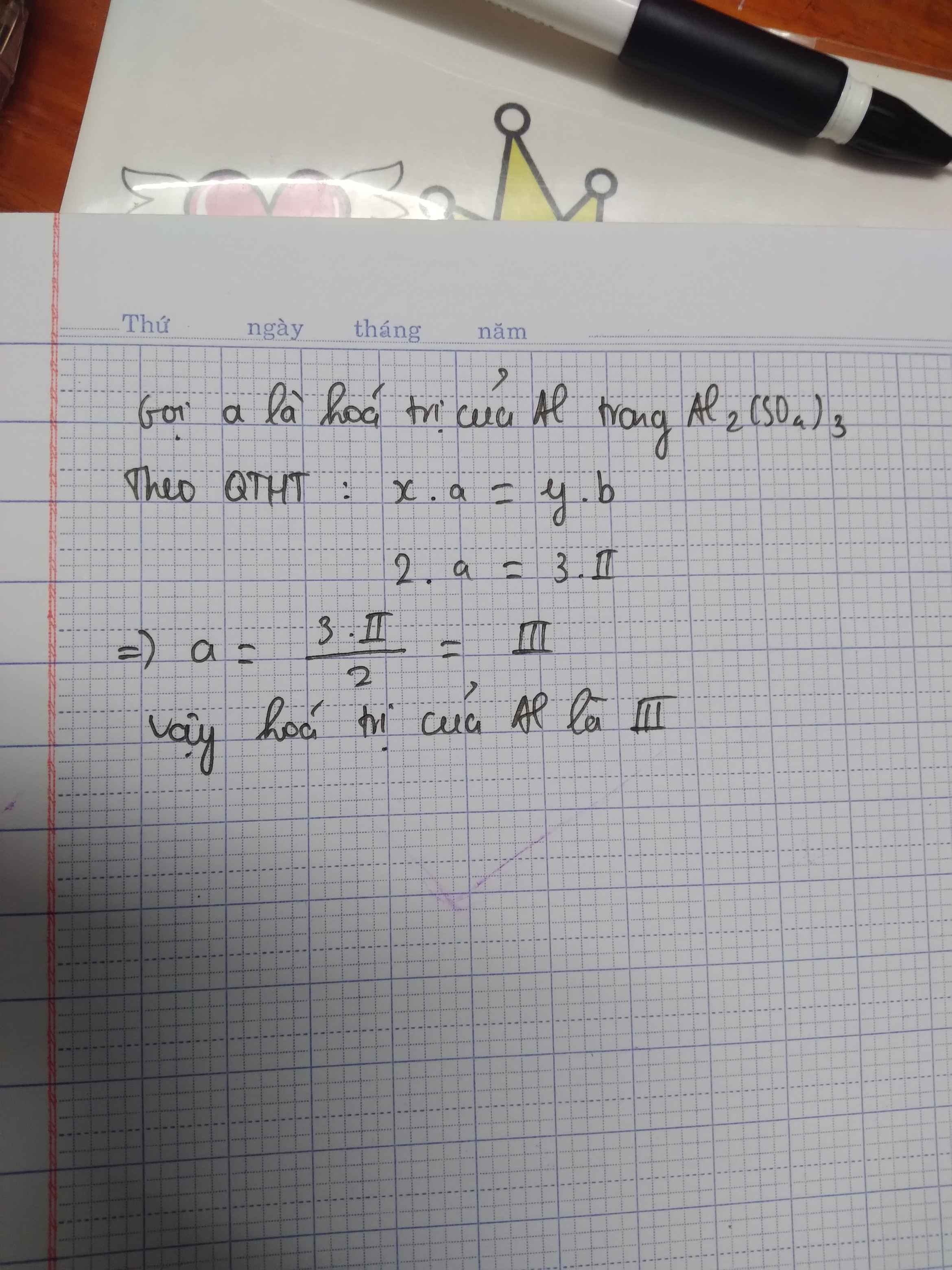 bài của em đây,chúc em học tốt nha ,tích cho chị vs luôn nhé
bài của em đây,chúc em học tốt nha ,tích cho chị vs luôn nhé



 chỉ mình bài 3 giúp ạ,mình cần gấp. cảm ơn trước nha
chỉ mình bài 3 giúp ạ,mình cần gấp. cảm ơn trước nha
Ví dụ một bài nha :v
Cho 5,4g Al tác dụng với axit sunfuric thu được muối và khí bay ra
a) Muối = ?
Giải : \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
Pt: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
2mol 1 mol
0,2mol -> 0,1mol
( Muốn tìm Muối -> bạn tìm số mol của nó thì lấy nAl đẩy sang bằng cách nhân chéo chia ngang (tam suất) \(\Rightarrow n_{muối}=\dfrac{0,2.1}{2}=0,1\)mol )
Mà có phải ý bạn là dạng bài tính theo kiểu này hả ? \(\uparrow\)
- Còn 1 cái nữa là sơ đồ đường chéo, cái này để tính phần pha trộn dung dịch