
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Cách khác:
\(Đặt.CTTQ: Fe_xO_y\left(x,y:nguyên,dương\right)\\ y=n_{CO}=n_{CO_2}=n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)\\ x=n_{Fe}=\dfrac{11,6-0,2.16}{2}=0,15\left(mol\right)\\ \Rightarrow x:y=0,15:0,2=3 :4\\ \Rightarrow x=3;y=4\\ \Rightarrow CTHH:Fe_3O_4\\ \Rightarrow B\)

Tổng hợp (1) và (2) ta có :
Cứ 3 x 22,4 m 3 hỗn hợp khí CO và H 2 qua Fe 2 O 3 thì thu được 2 x 56 kg Fe. 268,8 m 3 hỗn hợp khí CO và H 2 qua Fe 2 O 3 thì thu được x kg Fe.
x = 268,8 x 2 x 56/(3x22,4) = 448(kg) Fe

1) nAgCl = 0,03 mol = nCl trong muối sắt
=> mCl = 1,065g => mFe = m muối - mCl = 1,625 - 1,065 = 0,56g
=> nFe = 0,01 mol
nFe : nCl = 1:3 => FeCl3
2) nOH- : nH3PO4 = 1,375 => muối tạo thành là NaH2PO4 và Na2HPO4
Gọi số mol NaH2PO4 và Na2HPO4 lần lượt là a, b. Ta có hệ:
bảo toàn Na: a + 2b = 0,0275
Bảo toàn P: a + b = 0,02
=> a, b

Oxit dễ bị H2 khử ở nhiệt độ cao tạo thành kim loại là CuO vì đây là oxit của kim loại yếu
=> đáp án C đúng.

a.PTHH: FexOy + yCO \(\underrightarrow{t^o}\) xFe + yCO2
mFexOy = 16g
Sau phản ứng hoàn toàn, khối lượng chất rắn giảm 4,8g, suy ra mO = 4,8g.
=> mFe = mFexOy - mO = 11,2
=> nFe = 11,2/56=0,2mol và nO = 4,8/16=0,3
=> \(\dfrac{x}{y}=\dfrac{n_{Fe}}{n_O}=\dfrac{0,2}{0,3}=\dfrac{2}{3}\)
Vậy công thức oxit là Fe2O3.
b.PTHH: CO2 + Ca(OH)2 ➝ CaCO3 + H2O
Ta có : nCaCO3= nCO2 = nO = 0,3mol
=> mCaCO3 = 30g
c. Lượng CO dư 10% so với lý thuyết.
nCOlý thuyết = nCO2 = 0,3
nCOthực thế = nCOlý thuyết *110/100 = 0,33 mol
=> VCO = 7,392 lít
a) Đặt CTHHTQ của oxit sắt là : FexOy
PTHH 1 :
\(FexOy+yCO-^{t0}->xFe+yCO2\uparrow\)
Ta có :
m(giảm)= mO = mFexOy - mFe => mFe = 16 - 4,8 = 11,2 (g) => nFe = 0,2 (mol)
mO(trong oxit ) = 4,8(g) => nO = 0,3 (mol)
Ta có : \(\dfrac{nFe}{nO}=\dfrac{x}{y}=\dfrac{0,2}{0,3}=\dfrac{2}{3}\)
=> CTHH là Fe2O3 => nFe2O3 = 0,1 (mol) => nCO2 = 0,1 (mol)
b) \(PTHH\left(2\right):CO2+Ca\left(OH\right)2->CaCO3\downarrow+H2O\)
Theo PTHH 2 ta có : nCaCO3 = nCO2 = 0,1(mol)
=> mkt = mCaCO3 = 0,1.100 = 10((g)

Oxit dễ bị H2 khử ở nhiệt độ cao tạo thành kim loại là CuO vì đay là oxit kim loại yếu dễ bị khử
PTHH : CuO +H2---> Cu+H2O
=> đáp án đúng là C.

+nH2 = 0.896/22.4 = 0.04 (mol)
CuO + CO(t*) => Cu + CO2↑
0.01....0.01..........0.01..0.01
FexOy + yCO(t*) => xFe + yCO2↑
0.04/x........................0.04
_Chất rắn sau phản ứng là Fe và Cu => m(rắn) = mCu + mFe = 2.88
_Cu không phản ứng với dd HCl loãng:
Fe + 2HCl => FeCl2 + H2↑
0.04..0.08.......0.04.......0.04
=>mFe = 0.04*56 = 2.24(g)
=>mCu = 2.88 - 2.24 = 0.64 (g)
=>nCu = nCuO = 0.64/64 = 0.01 (mol)
=>mCuO = 0.01*80 = 0.8 (g)
=>mFexOy = 4 - 0.8 = 3.2(g)
a)
+nH2 = 0.896/22.4 = 0.04 (mol)
CuO + CO(t*) => Cu + CO2↑
0.01....0.01..........0.01..0.01
FexOy + yCO(t*) => xFe + yCO2↑
0.04/x........................0.04
_Chất rắn sau phản ứng là Fe và Cu => m(rắn) = mCu + mFe = 2.88
_Cu không phản ứng với dd HCl loãng:
Fe + 2HCl => FeCl2 + H2↑
0.04..0.08.......0.04.......0.04
=>mFe = 0.04*56 = 2.24(g)
=>mCu = 2.88 - 2.24 = 0.64 (g)
=>nCu = nCuO = 0.64/64 = 0.01 (mol)
=>mCuO = 0.01*80 = 0.8 (g)
=>mFexOy = 4 - 0.8 = 3.2(g)
b)
+mFe = 2.24 (g)
=>mO = 3.2 - 2.24 = 0.96 (g)
=>nFe = 2.24/56 = 0.04 (mol)
=>nO = 0.96/16 = 0.06 (mol)
=>nFe : nO = 0.04 : 0.06 = 2 : 3
Vậy công thức oxit sắt là Fe2O3.

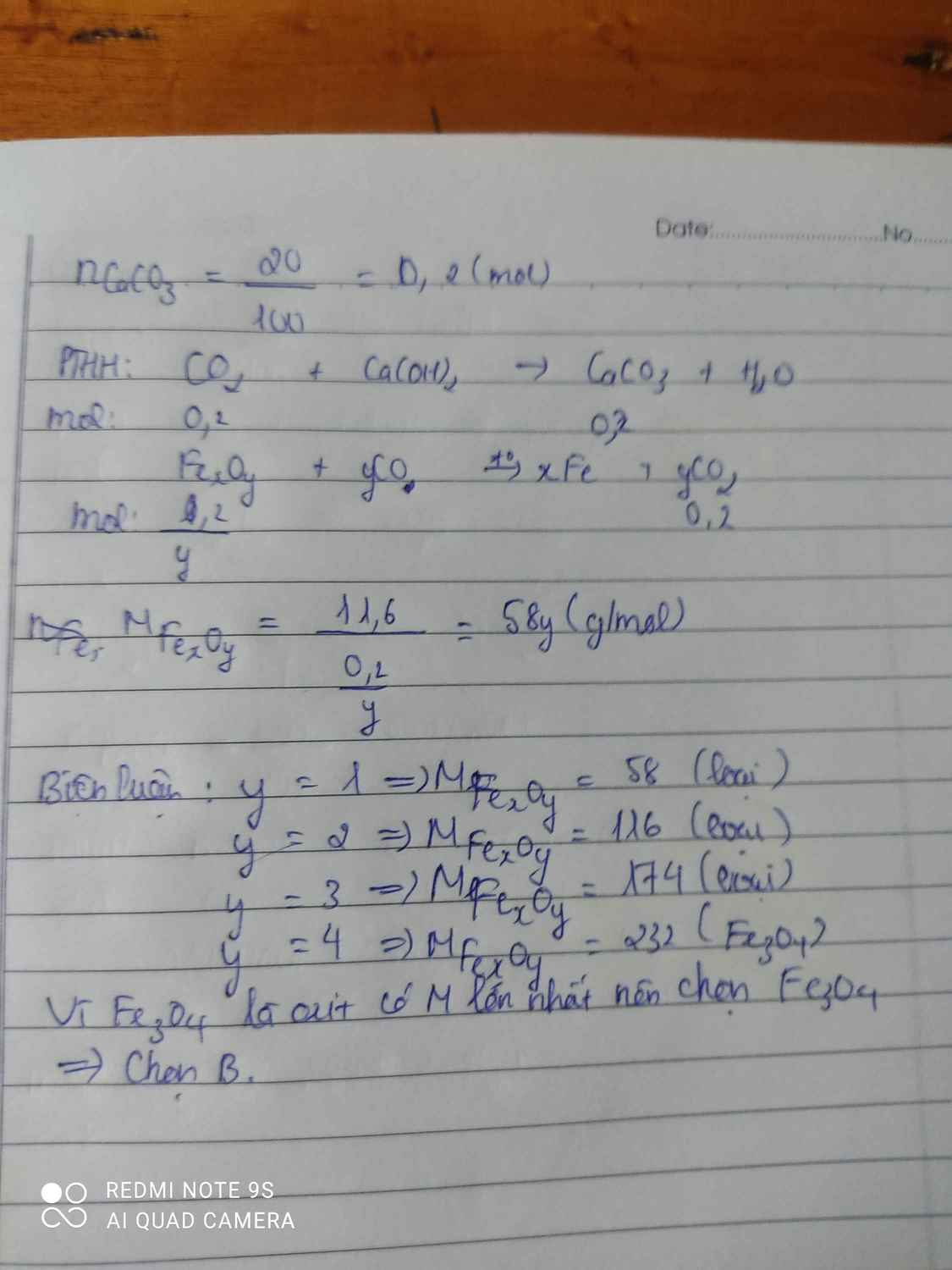
là Cu vì tính khử củ Cu còn yếu hơn của Fe
=> đáp án đúng là A