Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: \(4Fe+3O_2\rightarrow2Fe_2O_3\)
Ta có: \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\\n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,3}{4}>\dfrac{0,1}{2}\) \(\Rightarrow\) Sắt còn dư
\(\Rightarrow\left\{{}\begin{matrix}n_{O_2}=\dfrac{3}{2}n_{Fe_2O_3}=0,15\left(mol\right)\\n_{Fe\left(dư\right)}=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe\left(dư\right)}=0,1\cdot56=5,6\left(g\right)\\V_{O_2}=0,15\cdot22,4=3,36\left(l\right)\end{matrix}\right.\)

Bài 1:
a) nP=6,2/31=0,2(mol); nO2= 6,72/22,4=0,3(mol)
PTHH: 4P + 5 O2 -to-> 2 P2O5
Ta có: 0,2/4 < 0,3/5
=> P hết, O2 dư, tính theo nP
=> nO2(p.ứ)= 5/4. nP= 5/4. 0,2=0,25(mol)
=> mO2(dư)=0,3- 0,25=0,05(mol)
=> mO2(dư)=0,05.32=1,6(g)
b) nP2O5= nP/2= 0,2/2=0,1(mol)
=>mP2O5=0,1.142=14,2(g)

PTHH: \(Fe_3O_4+8HCl\rightarrow FeCl_2+2FeCl_3+4H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{Fe_3O_4}=\dfrac{23,2}{232}=0,1\left(mol\right)\\n_{HCl}=\dfrac{300\cdot3,65\%}{36,5}=0,3\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,3}{8}\) \(\Rightarrow\) Fe3O4 còn dư, HCl p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{Fe_3O_4\left(dư\right)}=0,0625\left(mol\right)\\n_{FeCl_2}=0,0375\left(mol\right)\\m_{FeCl_3}=0,075\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe_3O_4\left(dư\right)}=0,0625\cdot232=14,5\left(g\right)\\m_{muối}=0,0375\cdot127+0,075\cdot162,5=16,95\left(g\right)\end{matrix}\right.\)
nFe3O4= 23,2/232=0,1(mol); nHCl = (300.3,65%)/36,5= 0,3(mol)
a) PTHH: Fe3O4 + 8 HCl -> 2 FeCl3 + FeCl2 + 4 H2O
b) Ta có: 0,3/8 < 0,1/1
=> Fe3O4 dư, HCl hết, tính theo nHCl.
=> nFe3O4(p.ứ)= nFeCl2= nHCl/8=0,3/8= 0,0375(mol)
=> mFe3O4(dư)= (0,1- 0,0375).232=14,5(g)
c) nFeCl3= 2/8. 0,3= 0,075(mol)
=> mFeCl3= 0,075.162,5=12,1875(g)
mFeCl2= 0,0375. 127=4,7625(g)
=>m(muối)= 12,1875+ 4,7625= 16,95(g)

\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
\(n_{H_2SO_4}=0.2\cdot2=0.4\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(1.........1\)
\(0.2..........0.4\)
\(LTL:\dfrac{0.2}{1}< \dfrac{0.4}{1}\Rightarrow H_2SO_4dư\)
\(V_{H_2}=0.2\cdot22.4=4.48\left(l\right)\)
\(m_{H_2SO_4\left(dư\right)}=\left(0.4-0.2\right)\cdot98=19.6\left(g\right)\)
\(C_{M_{FeSO_4}}=\dfrac{0.2}{0.2}=1\left(M\right)\)

a, \(Fe+2HCl\rightarrow FeCl_2+H_2\)
b, \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{H_2}=0,4\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,4.56}{35}.100\%=64\%\\\%m_{Cu}=36\%\end{matrix}\right.\)

Bài 2:
Dd D gồm Ba(AlO2)2
\(\text{BaO+H2O}\rightarrow\text{Ba(OH)2}\)
\(\text{Ba(OH)2+Al2O3}\rightarrow\text{Ba(AlO2)2+H2O}\)
\(\text{CO2+Ba(AlO2)2+3H2O}\rightarrow\text{2Al(OH)3+Ba(HCO3)2}\)
Phần B không tan gồm FeO và Al2O3
\(\text{FeO+CO}\rightarrow\text{Fe+CO2}\)
\(\text{2Fe+Al2O3}\rightarrow\text{2Al+Fe2O3}\)
\(\text{Fe2O3+3CO}\rightarrow\text{2Fe+3CO2}\)
\(\rightarrow\) E gồm Fe và Al
\(\text{2Al+2NaOH+2H2O}\rightarrow\text{2NaAlO2+3H2}\)
\(\rightarrow\)G gồm Fe
\(\text{Fe+H2SO4}\rightarrow\text{FeSO4+H2}\)
\(\text{10FeSO4+2KMnO4+8H2SO4}\rightarrow\text{5Fe2(SO4)3+2MnSO4+K2SO4+8H2O}\)

Bài 1: Mg + HCl -----> MgCl2 + H2
Ag + HCl---/---> ko x/r pứ
a,T/có: nH2=5,6/22,4=0,25 mol
Theo PTHH: n Mg =n H2=0,25 mol
=>m Mg=0,25.24=6g
=>mAg = 27,6 - 6 = 21,6g
=>%m Mg=6.100%/27,6=21,7%
=>%m Ag =100%-21,7% = 78,3%
b.Theo PTHH: nHCl=2n H2 = 0,5 mol
=>m HCl=0,5.36,5=18,25g
=>m dd HCl=18,25.100% / 14,6% =125g
c.Theo PTHH:n MgCl2=nH2=0,25 mol
Theo định luật bt khlg: mdd sau pứ=m hỗn hợp + m dd HCl-m H2
=27,6+125-(0,25.2)=152,1g
=>C% dd MgCl2=0,25.95/152,1.100%=15,6%
d.Chất rắn:Ag
2Ag + 2H2SO4(đ,n)---------> Ag2SO4+SO2+2H2O
T/có: n Ag = 21,6/108=0,2 mol
Theo PTHH: n SO2 = 1/2 n Ag=0,1 mol
=>V H2(ở đktc)=0,1.22,4=2,24l
Theo PTHH: n H2SO4=nAg=0,2 mol
=>mH2SO4=0,2.98=19,6g
=>m ddH2SO4=19,6.100% /80%=24,5g

Ta có: nFe=5,656=0,1(mol)
nHCl=0,1.1=0,1(mol)
PT: Fe+2HCl→FeCl2+H2
Xét tỉ lệ: 0,11>0,12, ta được Fe dư.
a, Theo PT: nH2=12nHCl=0,05(mol)
⇒ VH2 = 0,05.22,4 = 1,12 (l)
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\\n_{HCl}=0,1\cdot1=0,1\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,1}{2}\) \(\Rightarrow\) Sắt còn dư, HCl p/ứ hết
\(\Rightarrow n_{Fe\left(dư\right)}=0,05\left(mol\right)=n_{FeCl_2}\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe\left(dư\right)}=0,05\cdot56=2,8\left(g\right)\\C_{M_{FeCl_2}}=\dfrac{0,05}{0,1}=0,5\left(M\right)\end{matrix}\right.\)

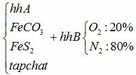
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
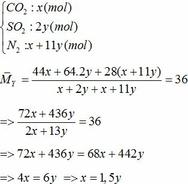
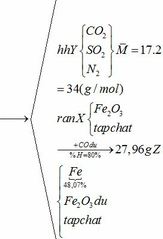
Khối lượng Fe có trong Z là:
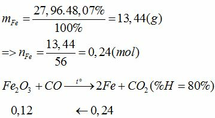
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
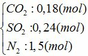
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
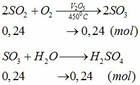
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
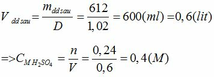
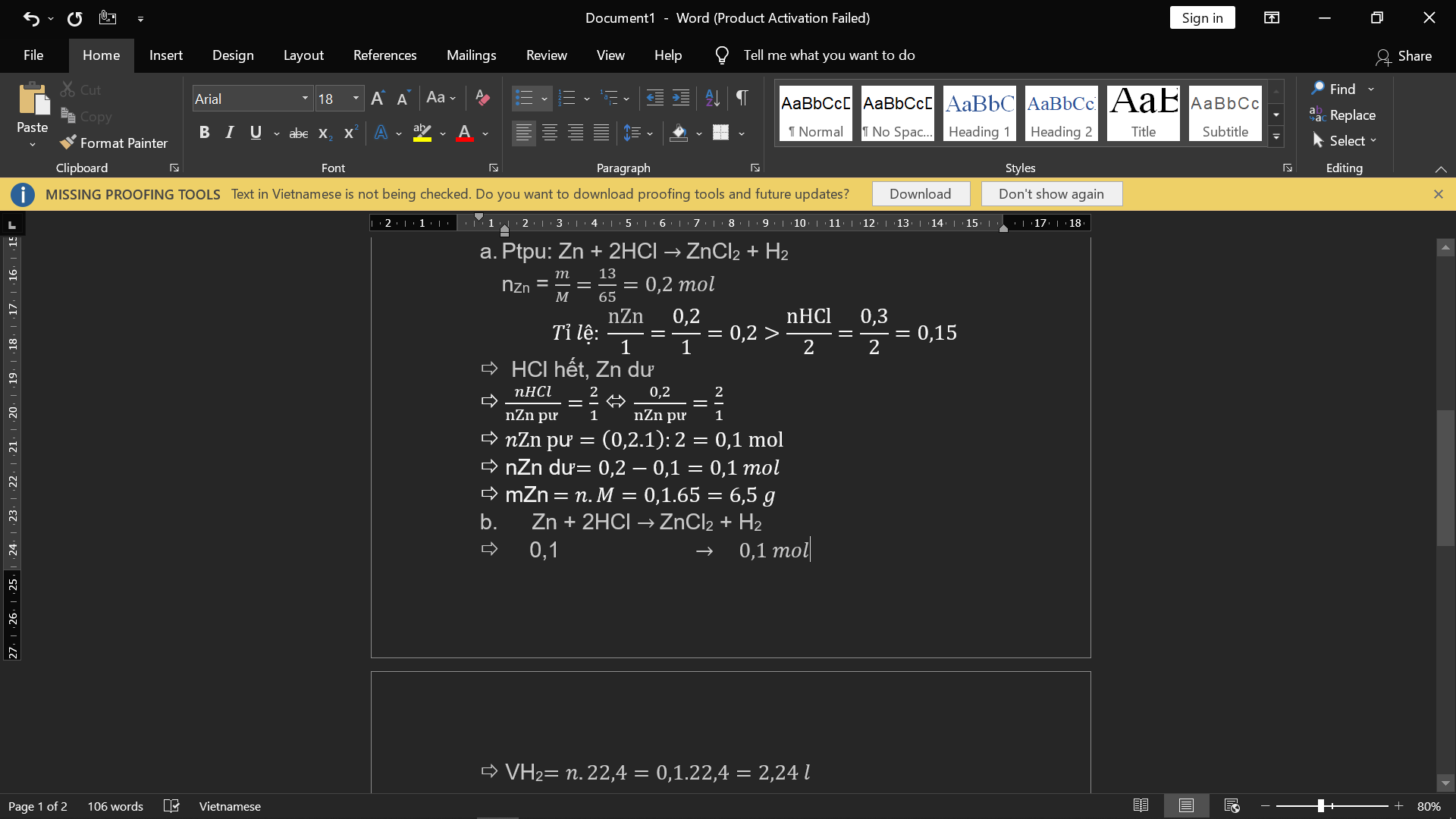
vd1theo bài ra ta có :
mS = 3,2g => nS = 0,1 mol
mFe = 11,2 g => nFe = 0,2mol
pthh:
Fe + S - > FeS
1mol......1mol.......1mol
0,2mol....0,1mol
theo pt: nFe = nS
theo gt: nFe>nS ( 0,2>0,1)
=> Fe dư
theo pthh ta có nFeS = nS = 0,1mol
=> mFeS = 0,1 . 88 = 8,8(g)
ta có nFe(dư) = 0,2 - 0,1 = 0,1 mol
=> mFe(dư) = 0,1 . 56 = 5,6 (g)
vd2
a, PTHH:
4Fe + 3O2 ---> 2Fe2O3
nFe2O3=16/160=0,1(mol)
Theo PTHH:
nFephản ứng=4/2*nFe2O3=2*0,1=0,2(mol)
=>mFephản ứng=0,2*56=11,2(g)
Theo định luật bảo toàn khối lượng thì sản phẩm tạo thành bằng khối lượng các chất tham gia phản ứng.
Mà khối lượng sắt phản ứng là 11,2g
=> Còn lại là O2
Vậy Oxi phản ứng hết, sắt còn dư.
b, Theo PTHH:
nO2=3/2*nFe2O3=3/2*0,1=0,15(mol)
=>VO2=0,15*22,4=3,36(lít)
Mình tính, Khối lượng Fe dư là:5,6g
Còn 11,2g là khối lượng Fe đã phản ứng