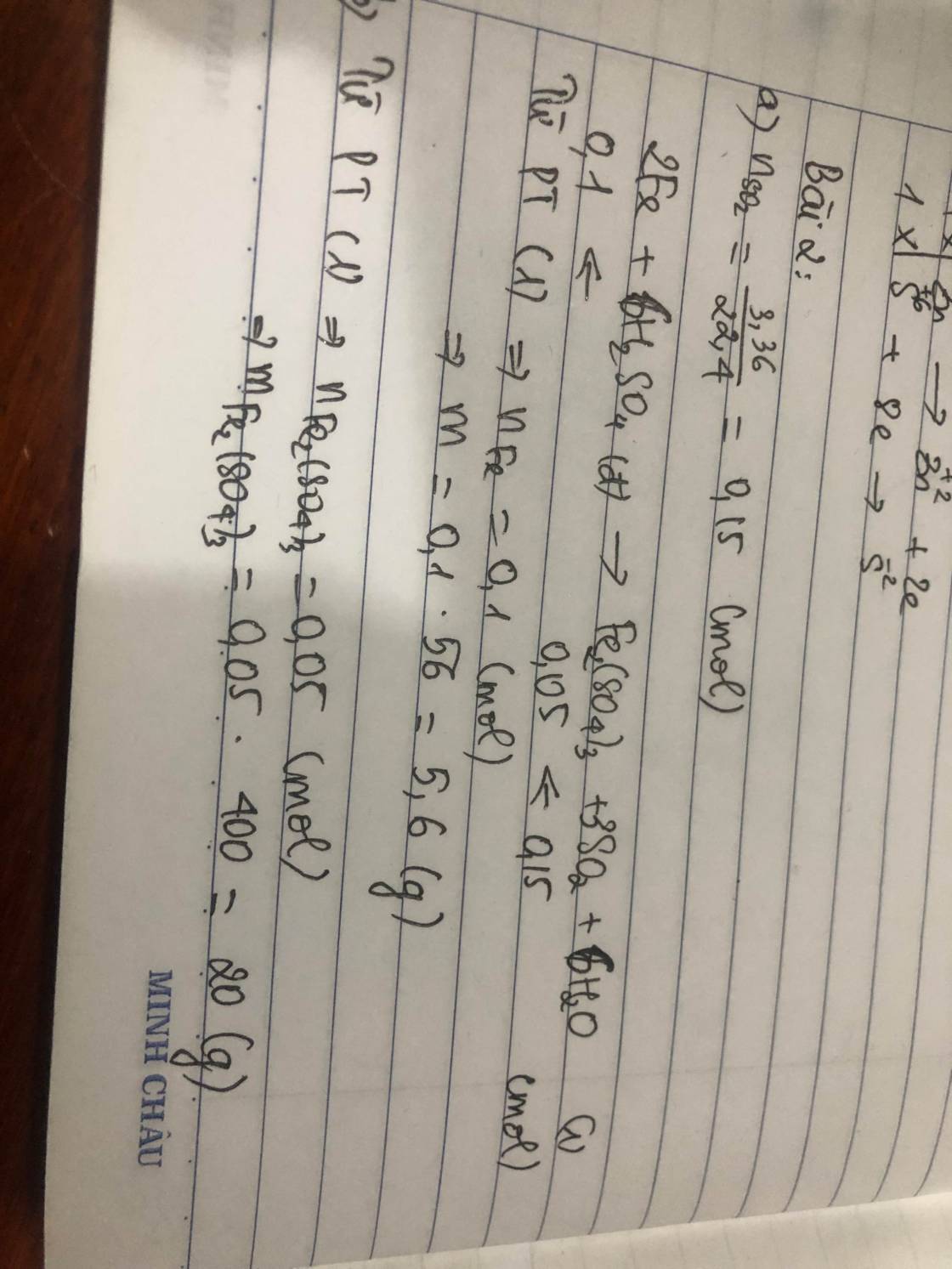Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi x,y lần lượt là số mol của Zn và Al
Theo đề ta có mHỗnhợp=65x+27y=9,2(1)
nSO2=5,6:22,4=0,25mol
BTE:2x+3y=2.0,25=0,5(2)
Từ (1) và (2) => x=0,1;y=0,1
mAl=0,1.27=2,7g
Gọi x,y lần lượt là số mol của Zn và Al
Theo đề ta có mHỗnhợp=65x+27y=9,2(1)
nSO2=5,6:22,4=0,25mol
BTE:2x+3y=2.0,25=0,5(2)
Từ (1) và (2) => x=0,1;y=0,1
mAl=0,1.27=2,7g
Chúc bạn học tốt!!!

Có thể xem công thức Fe3O4 là FeO.Fe2O3 nên hỗn hợp X có thể được xem như gồm FeO và Fe2O3.
Gọi a là số mol FeO, b là số mol Fe2O3 của 0,5 m gam X.
FeO + H2SO4 --->FeSO4 + H2O
Fe2O3 + 3H2SO4 ---> Fe2(SO4)3 + 3H2O
từ khối lượng muối khan ở phần 1, ta có phương trình
152a + 400b = 31,6 gam (1)
Phần 2 khi cho Cl2 vào thì xảy ra pu:
FeSO4 + 0,5 Cl2 ---> 1/3 Fe2(SO4)3 + 1/3 FeCl3
--> khối lượng muối ở phần 2 = 400a/3 + 162,5a/3 + 400b = 33,375 gam
--> 562a + 1200b = 100,125 (2)
Từ (1) và (2) suy ra :
a =0,0502358 mol
b = 0,0599153 mol
--> Khối lượng hỗn hợp X = 2 x (72 x 0,0502358 + 160 x 0,0599153) = 26,712448 gam
a.
Phương trình
+ Khi hòa A bằng axit H2SO4 loãng
FeO + H2SO4 \(\rightarrow\) FeSO4 + H2O (1)
Fe2O3 + 3H2SO4 \(\rightarrow\) Fe2(SO4)3 + 3H2O (2)
Fe3O4 + 4H2SO4 \(\rightarrow\) Fe2(SO4)3 + FeSO4+ 3H2O (3)
Sau phản ứng dung dịch chỉ có 2 muối (x+z)mol FeSO4 và (y+z) mol Fe2(SO4)3
+ Khi sục khí Cl2 vào dung dịch sau phản ứng chỉ có FeSO4 phản ứng
6FeSO4 + 3Cl2 \(\rightarrow\) 2FeCl3 + 2Fe2(SO4)3 (4)
b.
Theo bài ta có hệ phương trình
\(\begin{cases}72x+160y+232z=m\text{/}2\\152\left(x+z\right)+400\left(y+z\right)=31,6\\187,5\left(x+z\right)+400\left(y+z\right)=33,375\end{cases}\)\(\begin{matrix}\left(I\right)\\\left(II\right)\\\left(III\right)\end{matrix}\)
Từ II, III ta có x+z= 0,05; y+z=0,06
Mặt khác từ I ta có m=2.[ 72(x+z) + 160(y+z)]=26,4 gam
Vậy m= 26,4g
\(C_{FeSO_4}\)=0,2M; \(C_{Fe_2\left(SO_4\right)_3}\)=0,24M

\(a.2Fe+6H_2SO_{4\left(đặc\right)}\rightarrow\left(t^o\right)Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\\ n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ n_{Fe}=\dfrac{2}{3}.0,15=0,1\left(mol\right)\\ n_{Fe_2\left(SO_4\right)_3}=\dfrac{0,15}{3}=0,05\left(mol\right)\\ a,m=m_{Fe}=0,1.56=5,6\left(g\right)\\ b,m_{Fe_2\left(SO_4\right)_3}=400.0,05=20\left(g\right)\)

a) Phương trình hóa học của phản ứng
Na2CO3 + 2HNO3 → 2NaNO3 + CO2 + H2O
b) Thí nghiệm có thể xảy ra nên điều kiện phản ứng được thỏa mãn
=> Axit mới sinh ra H2CO3 yếu hơn HNO3 nên đã phân hủy thành khí CO2 và H2O

a/ PTHH: R + 2HCl ===> RCl2 + H2
nH2 = 2,688 / 22,4 = 0,12 (mol)
nR = nH2 = 0,12 mol
=> MR = 6,72 / 0,12 = 56 (g/mol)
=> R là Fe

Hòa tan hỗn hợp 1,69g Oleum có công thức H2SO4.3SO3 vào nước dư. Trung hòa dung dịch thu được Vml dung dịch KOH 1M. Giá trị của V là:
A.20
B.40
C.30
D.10
Giải thích:
\(H2SO4.3SO3+H2O=4H2SO4\)
\(n\left(o\le um\right)=0.005mol\)
\(\Rightarrow nH2SO4=0.005.4=0.02mol\)
\(H2SO4+2KOH=K2SO4+H2O\)
\(\Rightarrow nKOH=0.04\)
\(\Rightarrow\) Giá trị của V là: 40

1.a. Sơ đồ các quá trình phản ứng
Kim loại + Oxi \(\rightarrow\) (hỗn hợp oxit ) + axit \(\rightarrow\) muối + H2O
Từ quá trình trên => số mol H2SO4 phản ứng = số mol oxi trong oxit
Theo bài ta có: moxi = 39,2 – 29,6 = 9,6(g)
=> \(n_O=\frac{9,6}{16}=0,6mol\)
=> số mol H2SO4 phản ứng = 0,6 (mol)
b. Khối lượng muối = khối lượng kim loại + khối lượng gốc sunfat
=> mm = 29,6 + 96. 0,6 = 87,2 (g)
2. Gọi công thức của oxit cần tìm là MxOy
Phương trình phản ứng.
MxOy + yH2 \(\rightarrow\) xM + yH2O (1)
\(n_{H_2}=\frac{985,6}{22,4.1000}=0,044\left(mol\right)\)
Theo định luật bảo toàn khối lượng
=> khối lượng kim loại = 2,552 + 0,044.2 – 0,044.18 = 1,848(g)
Khi M phản ứng với HCl
2M + 2nHCl \(\rightarrow\) 2MCln + nH2 (2)
\(n_{H_2}=\frac{739,2}{22,4.1000}=0,033\left(mol\right)\)
(2) => \(\frac{1,848}{M}.n=2.0,033\)
=> M = 28n
Với n là hóa trị của kim loại M
Chỉ có n = 2 với M = 56 (Fe) là thỏa mãn
Theo (1) \(\frac{x}{y}=\frac{n_M}{n_{H_2}}=\frac{0,033}{0,044}=\frac{3}{4}\)
=> oxit cần tìm là Fe3O4
1.a. Sơ đồ các quá trình phản ứng
Kim loại + Oxi (hỗn hợp oxit ) + axit muối + H2O
Từ quá trình trên => số mol H2SO4 phản ứng = số mol oxi trong oxit
Theo bài ta có: moxi = 39,2 – 29,6 = 9,6(g)
=>
=> số mol H2SO4 phản ứng = 0,6 (mol)
b. Khối lượng muối = khối lượng kim loại + khối lượng gốc sunfat
=> mm = 29,6 + 96. 0,6 = 87,2 (g)
2. Gọi công thức của oxit cần tìm là MxOy
Phương trình phản ứng.
MxOy + yH2 xM + yH2O (1)
Theo định luật bảo toàn khối lượng
=> khối lượng kim loại = 2,552 + 0,044.2 – 0,044.18 = 1,848(g)
Khi M phản ứng với HCl
2M + 2nHCl 2MCln + nH2 (2)
(2) =>
=> M = 28n
Với n là hóa trị của kim loại M
Chỉ có n = 2 với M = 56 (Fe) là thỏa mãn
Theo (1)
=> oxit cần tìm là Fe3O4

a) \(n_{H_2}=0,15\left(mol\right)\)
Gọi CTTB của hai kim loại là \(\overline{R}\)
PTHH : \(2\overline{R}+H_2SO_4-->\overline{R}_2SO_4+H_2\uparrow\) (1)
Theo pthh : \(n_{\overline{R}}=2n_{H_2}=0,3\left(mol\right)\)
=> \(M_{\overline{R}}=\frac{10,1}{0,3}\approx33,67\) (g/mol)
Mà hai kim loại thuộc hai chu kì liên tiếp => \(\hept{\begin{cases}Natri:23\left(Na\right)\\Kali:39\left(K\right)\end{cases}}\)
b) \(tổng.n_{H_2SO_4}=\frac{100\cdot19,6}{100\cdot98}=0,2\left(mol\right)\)
Theo pthh : \(n_{H_2SO_4\left(pứ\right)}=n_{H_2}=0,15\left(mol\right)\)
=> \(n_{H_2SO_4\left(dư\right)}=0,2-0,15=0,05\left(mol\right)\)
PTHH : \(2Na+H_2SO_4-->Na_2SO_4+H_2\) (2)
\(2K+H_2SO_4-->K_2SO_4+H_2\) (3)
Đặt : \(\hept{\begin{cases}n_{Na}=x\left(mol\right)\\n_K=y\left(mol\right)\end{cases}}\) \(\Rightarrow23x+39y=10,1\left(I\right)\)
Theo pt (2); (3) : \(tổng.n_{H_2}=\frac{1}{2}n_{Na}+\frac{1}{2}n_K\)
\(\Rightarrow\frac{x}{2}+\frac{y}{2}=0,15\left(II\right)\)
Theo (I) và (II) => \(\hept{\begin{cases}x=0,1\\y=0,2\end{cases}}\)
Theo pthh (2) : \(n_{Na_2SO_4}=\frac{1}{2}n_{Na}=0,05\left(mol\right)\)
(3) : \(n_{K_2SO_4}=\frac{1}{2}n_K=0,1\left(mol\right)\)
Áp dụng ĐLBTKL : \(m_{hh}+m_{ddH_2SO_4}=m_{ddspu}+m_{H_2}\)
=> \(10,2+100=m_{ddspu}+2\cdot0,15\)
=> \(m_{ddspu}=109,9\left(g\right)\)
=> \(\hept{\begin{cases}C\%_{Na_2SO_4}=\frac{142\cdot0,05}{109,9}\cdot100\%\approx6,46\%\\C\%_{K_2SO_4}=\frac{174\cdot0,1}{109,9}\cdot100\%\approx15,83\%\\C\%_{H_2SO_4}=\frac{98\cdot0,05}{109,9}\cdot100\%\approx4,46\%\end{cases}}\)
c) ktr lại đề nhé. phần 3,7 (g) ra số liệu hơi lẻ :((