Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{HNO_3}=1.2\left(mol\right)\)
\(n_{NO}=a\left(mol\right)\)
\(n_{NO_2}=b\left(mol\right)\)
\(n_{N_2}=c\left(mol\right)\)
\(\Rightarrow a+b+c=\dfrac{5.6}{22.4}=0.25\left(1\right)\)
Bảo toàn e :
\(3\cdot0.2+1\cdot0.3=3a+b+10c\left(2\right)\)
\(n_{H^+}=4n_{NO}+2n_{NO_2}+12n_{N_2}\)
\(\Rightarrow4a+2b+12c=1.2\left(3\right)\)
\(\left(1\right),\left(2\right),\left(3\right):a=b=0.1,c=0.05\)
\(\%V_{NO_2}=\dfrac{0.1}{0.25}\cdot100\%=40\%\%0-\)

Coi hh X gồm Fe, Cu và O
Đặt \(n_{Fe\left(Fe_xO_y\right)}=a;n_{Cu}=b;n_{O\left(Fe_xO_y\right)}=c\) ( mol )
\(\Rightarrow m_{hh}=56a+64b+16c=14,64\left(g\right)\) (1)
\(m_{muối}=m_{Fe\left(NO_3\right)_3}+m_{Cu\left(NO_3\right)_2}=242a+188b=47,58\left(g\right)\) (2)
Bảo toàn e: \(3n_{Fe}+2n_{Cu}=2n_O+3n_{NO}=3a+2b=2c+3.0,09\) (3)
\(\left(1\right);\left(2\right);\left(3\right)\Rightarrow\left\{{}\begin{matrix}a=0,15\\b=0,06\\c=0,15\end{matrix}\right.\)
\(\%m_{Cu}=\dfrac{0,06.64}{14,64}.100=26,22\%\)
\(\dfrac{x}{y}=\dfrac{0,15}{0,15}=\dfrac{1}{1}\Rightarrow CTHH:FeO\)

\(n_{Fe}=\dfrac{5,6}{56}=0,1mol\\ 3Fe+8HNO_3\rightarrow3Fe\left(NO_3\right)_2+2NO+4H_2O\\ n_{Fe\left(NO_3\right)_2}=n_{Fe}=0,1mol\\ m_{Fe\left(NO_3\right)_2}=0,1.180=18g\\ n_{NO}=0,1\cdot\dfrac{2}{3}=\dfrac{1}{15}mol\\ V_{NO}=\dfrac{1}{15}\cdot22,4=\dfrac{112}{75}\approx1,49l\)

\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
\(n_{HNO_3}=1.0,5=0,5\left(mol\right)\)
PTHH: Fe + 4HNO3 --> Fe(NO3)3 + NO + 2H2O
0,1--->0,4---------->0,1
=> dd sau pư chứa \(\left\{{}\begin{matrix}Fe\left(NO_3\right)_3:0,1\left(mol\right)\\HNO_{3\left(dư\right)}:0,5-0,4=0,1\left(mol\right)\end{matrix}\right.\)
PTHH: 3Cu + 8HNO3 --> 3Cu(NO3)2 + 2NO + 4H2O
0,0375<-0,1
2Fe(NO3)3 + Cu --> 2Fe(NO3)2 + Cu(NO3)2
0,1---->0,05
=> m = (0,0375 + 0,05).64 = 5,6 (g)

Đáp án C
Quy đổi hỗn hợp về Fe (x mol); Cu (y mol) và S (z mol)
Bảo toàn S có
nS = n↓ = 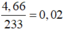 (mol)
(mol)
mX = 2,72 gam → 56x + 64y + 0,02.32 = 2,72 → 56x + 64y = 2,08 (1)
Do Y có thể hòa tan được Cu, bảo toàn electron có:
3.nFe + 2.nCu + 6.nS = 3.0,07 → 3x + 2y = 0,09 (2)
Từ (1) và (2) có: x = 0,02 và y = 0,015.
Dung dịch Y gồm: Fe3+: 0,02 mol; Cu2+: 0,015 mol; SO42- = 0,02 mol; NO3- = (0,5 – 0,07 = 0,43 mol) và có thể có H+
Bảo toàn điện tích → nH+ = 0,38 mol
Cho Cu vào Y có phản ứng:
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
0,1425 ← 0,38 0,43 mol
Cu + 2Fe3+ → Cu2+ + 2Fe2+
0,01 ← 0,02 mol
m = (0,01 + 0,1425).64 = 9,76 gam.

Gọi số mol Fe là a (mol)
Fe0 - 3e --> Fe+3
a--->3a
N+5 + 1e --> N+4
0,06->0,06
N+5 + 3e --> N+2
0,03->0,09
Bảo toàn e: 3a = 0,15
=> a = 0,05 (mol)
=> m = 0,05.56 = 2,8 (g)

a) \(n_{Cu}=\dfrac{1,92}{64}=0,03\left(mol\right)\)
\(n_{Fe}=\dfrac{3,36}{56}=0,06\left(mol\right)\)
Fe0 - 3e --> Fe+3
0,06->0,18
Cu0 - 2e --> Cu+2
0,03->0,06
N+5 + 3e --> N+2
3a<--a
Bảo toàn e: 3a = 0,24
=> a = 0,08 (mol)
b)
\(\left\{{}\begin{matrix}n_{Fe\left(NO_3\right)_3}=0,06\left(mol\right)\\n_{Cu\left(NO_3\right)_2}=0,03\left(mol\right)\end{matrix}\right.\)
Bảo toàn N: \(n_{HNO_3}=0,06.3+0,03.2+0,08=0,32\left(mol\right)\)

Hòa tan hoàn toàn 15,2 gam hỗn hợp gồm Fe và Cu trong dung dịch HNO3, thu được dung dịch X và 4,48 lút khí NO. Cho 3,96 gam kim loại Mg vào X đến khi phản ứng xảy ra hoàn toàn, thu được 224ml khí NO và m gam chất rắn không tan. biết NO là sản phẩm khử duy nhất của N+5. Gía trị cảu m là
A. 6,4 B.12,8 C.9,6 D.4,8