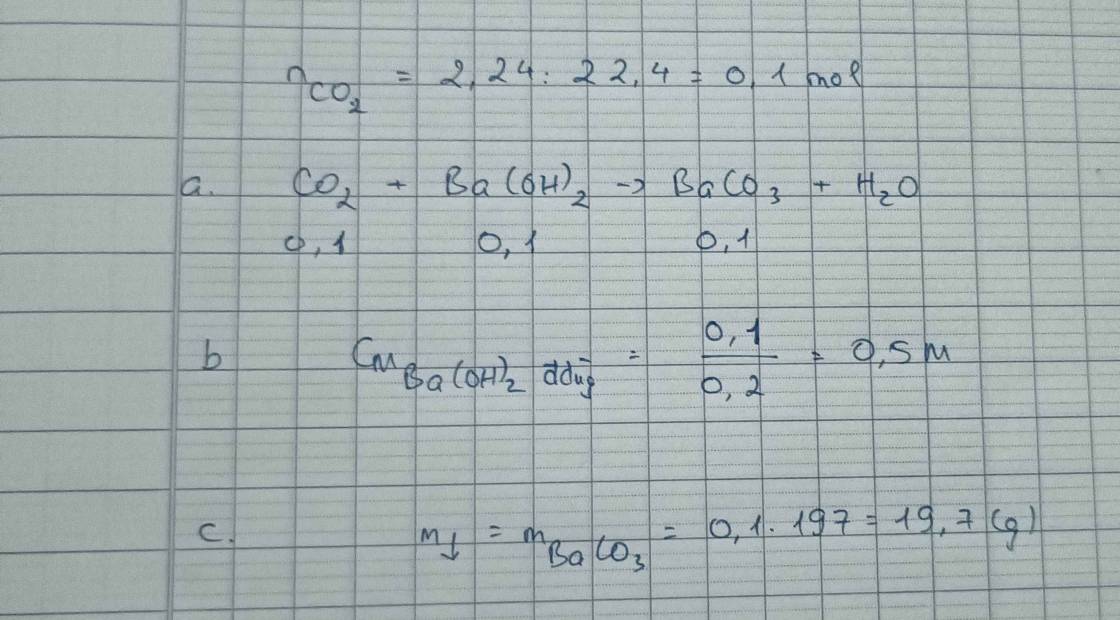Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) CO2 +Ba(OH)2---->BaCO3 +H2O
b)n CO2 =0,1
nCO2 = nBa(OH)2 =0,1
----->Cm =0,5M
c)nCO2 = nBa(OH)2 =0,1
--->mBa(OH)2 =17,1
a ) \(CO_2+Ba\left(OH\right)_2--->BaCO_3+H_2O\)
b ) \(n_{CO_2}=0,1\)
\(n_{CO_2}=n_{Ba}\left(OH\right)_2=0,1\)
\(--->Cm=0,5M\)
c ) \(n_{CO_2}=n_{Ba}\left(OH\right)_2=0,1\)
\(--->m_{Ba}\left(OH\right)_2=17,1\).

Số mol CO2 = 2,24:22,4 = 0,1 mol
a) CO2 + Ba(OH)2 → BaCO3 + H2O
Phản ứng: 0,1 → 0,1 0,1
b) Số mol Ba(OH)2 có trong 200 ml dung dịch là 0,1 mol
CM Ba(OH)2 = 0,10,20,10,2 = 0,5 M
c) Chất kết tủa thu được sau phản ứng là BaCO3 có số mol là 0,1
m BaCO3 = 0,1 x 197 = 19,7 g
\(n_{CO_2}=\dfrac{2,24}{22,4}0,1\left(mol\right)\)
\(CO_2+Ba\left(OH\right)_2\rightarrow BaCO_3+H_2O\)
1 : 1 : 1 : 1
0,1 \(\rightarrow\)0,1 \(\rightarrow0,1\)
đổi 200ml=0,2l
\(C_M=\dfrac{0,1}{0,2}0,5\left(M\right)\)
ta có từ bảng trang 170,chất kết tủa là\(BaCO_3\)
\(\Rightarrow n_{BaCO_3}=o,1\left(mol\right)\)
\(\Rightarrow m_{BaCO_3}=0,1.196=19,6\left(g\right)\)

a/ PTHH : \(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3\downarrow+H_2O\)
b/ \(n_{CO_2}=\frac{22,4}{22,4}=1\left(mol\right)\)
Từ PTHH suy ra \(n_{Ba\left(OH\right)_2}=n_{CO_2}=1\left(mol\right)\)
\(\Rightarrow C_{M_{Ba\left(OH\right)_2}}=\frac{n_{Ba\left(OH\right)_2}}{V_{Ba\left(OH\right)_2}}=\frac{1}{\frac{200}{1000}}=5M\)
c/ \(n_{BaCO_3}=n_{CO_2}=1\left(mol\right)\Rightarrow m_{BaCO_3}=1\times197=197\left(g\right)\)

a) CO2 +Ba(OH)2---->BaCO3 +H2O
b)n CO2 =0,1
nCO2 = nBa(OH)2 =0,1
----->Cm =0,5M
c)nCO2 = nBa(OH)2 =0,1
--->mBa(OH)2 =17,1
nCO2 = 2.24 / 22.4 = 0.1(mol)
a) phương trình phản ứng: CO2 + Ba(OH)2 -> BaCO3 + H2O
theo phương trình ta có: nBa(OH)2 = nCO2 = 0.1(mol)
b) Nồng độ mol/l của dung dịch Ba(OH)2 đã dùng là:
CM = n / V = 0.1 : ( 200 /1000) = 0.5 (M)
c) theo phương trình ta có : nBaCO3 = nCO2 = 0.1 (mol)
khối lượng chất kết tủa BaCO3 là:
mBaCO3 = 0.1* 197 = 19.7 (g)

2 Lấy cùng một thể tích dd NaOH cho vào 2 cốc thủy tinh riêng biệt. Giả sử lúc đó mối cốc chứa a mol NaOH.
Sục CO2 dư vào một cốc, phản ứng tạo ra muối axit.
CO2 + 2NaOH → Na2CO3 + H2O (1)
CO2 + Na2CO3 + H2O → 2NaHCO3 (2)
Theo pt (1,2) nNaHCO3 = nNaOH = a (mol)
* Lấy cốc đựng muối axit vừa thu được đổ từ từ vào cốc đựng dung dịch NaOH ban đầu. Ta thu được dung dịch Na2CO3 tinh khiết
NaHCO3 + NaOH → Na2CO3 + H2O
1.Kết tủa A là BaSO4, dung dịch B có thể là H2SO4 dư hoặc Ba(OH)2
TH1: Dung dịch B là H2SO4 dư
Dung dịch C là Al2(SO4)3 ; Kết tủa D là Al(OH)3
TH2: Dung dịch B là Ba(OH)2
Dung dịch C là: Ba(AlO2)2 ; Kết tủa D là BaCO3
các pthh
BaO + H2SO4 → BaSO4 + H2O
BaO + H2O → Ba(OH)2
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Al2(SO4)3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 3CO2 + 3Na2SO4
Ba(OH)2 + 2H2O + 2Al → Ba(AlO2)2 + 3H2
Ba(AlO2)2 + Na2CO3 → BaCO3 + 2NaAlO2

\(n_{MgCO3}=\dfrac{8,4}{84}=0,1\left(mol\right)\)
a) Pt : \(2CH_3COOH+MgCO_3\rightarrow\left(CH_3COO\right)_2Mg+CO_2+H_2O|\)
2 1 1 1 1
0,2 0,1 0,1 0,1
b) \(n_{CH3COOH}=\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
⇒ \(m_{CH3COOH}=0,2.60=12\left(g\right)\)
\(C_{ddCH3COOH}=\dfrac{12.100}{200}=6\)0/0
\(n_{\left(CH3COO\right)2Mg}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
⇒ \(m_{\left(CH3COO\right)2Mg}=0,1.142=14,2\left(g\right)\)
\(m_{ddspu}=8,4+200-\left(0,1.44\right)=204\left(g\right)\)
\(C_{dd\left(CH3COO\right)2Mg}=\dfrac{14,2.100}{204}=6,96\)0/0
Chúc bạn học tốt

600ml=0,6l
nFeCl3=0,6.0,5=0.3mol
pt : 2FeCl3 + 3Ba(OH)2 -------> 2Fe(OH)3\(\downarrow\) + 3BaCl2
n pứ : 0,3-------->0,45----------------> 0.3----------->0.45
Vdd Ba(OH)2=0.45/1=0,45l
mFe(OH)3=0,3.107=32,1g
VddBaCl2 = VddFeCl3 + VddBa(OH)2
=0,6+0,45=1,05l
CM(BaCl2)=0,45/1,05\(\simeq0.43M\)
a) 2FeCl3 + 3Ba(OH)2 → 3BaCl2 + 2Fe(OH)3↓
\(n_{FeCl_3}=0,6\times0,5=0,3\left(mol\right)\)
Theo PT: \(n_{Fe\left(OH\right)_3}=n_{FeCl_3}=0,3\left(mol\right)\)
\(\Rightarrow m_{Fe\left(OH\right)_3}=0,3\times107=32,1\left(g\right)\)
b) Theo PT: \(n_{Ba\left(OH\right)_2}=\dfrac{3}{2}n_{FeCl_3}=\dfrac{3}{2}\times0,3=0,45\left(mol\right)\)
\(\Rightarrow V_{ddBa\left(OH\right)_2}=\dfrac{0,45}{1}=0,45\left(l\right)=450\left(ml\right)\)
c) \(V_{dd}saupư=V_{ddFeCl_3}+V_{ddBa\left(OH\right)_2}=0,6+0,45=1,05\left(l\right)\)
Theo PT: \(n_{BaCl_2}=\dfrac{3}{2}n_{FeCl_3}=\dfrac{3}{2}\times0,3=0,45\left(mol\right)\)
\(\Rightarrow C_{M_{ddBaCl_2}}=\dfrac{0,45}{1,05}=0,43\left(M\right)\)

1/Gọi công thức oxit kim loại:MxOy
_Khi cho tác dụng với khí CO tạo thành khí CO2.
MxOy+yCO=>xM+yCO2
_Cho CO2 tác dụng với dd Ca(OH)2 tạo thành CaCO3:
nCaCO3=7/100=0.07(mol)=nCO2
CO2+Ca(OH)2=>CaCO3+H2O
0.07------------------>0.07(mol)
=>nO=0.07(mol)
=>mO=0.07*16=1.12(g)
=>mM=4.06-1.12=2.94(g)
_Lượng kim loại sinh ra tác dụng với dd HCl,(n là hóa trị của M)
nH2=1.176/22.4=0.0525(mol)
2M+2nHCl=>2MCln+nH2
=>nM=0.0525*2/n=0.105/n
=>M=28n
_Xét hóa trị n của M từ 1->3:
+n=1=>M=28(loại)
+n=2=>M=56(nhận)
+n=3=>M=84(loại)
Vậy M là sắt(Fe)
=>nFe=0.105/2=0.0525(mol)
=>nFe:nO=0.0525:0.07=3:4
Vậy công thức oxit kim loại là Fe3O4.

a. PTHH: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
b. Có \(n_{Mg}=\frac{3,6}{24}=0,15mol\)
\(140ml=0,14l\)
\(n_{H_2SO_4}=0,14.1,2=0,168mol\)
Lập tỉ lệ \(\frac{n_{Mg}}{1}< \frac{n_{H_2SO_4}}{1}\)
Vậy Mg đủ, \(H_2SO_4\) dư
Theo phương trình \(n_{H_2SO_4}=n_{Mg}=0,15mol\)
\(\rightarrow n_{H_2SO_4\left(\text{(dư)}\right)}=0,168-0,15=0,018mol\)
\(\rightarrow m_{H_2SO_4\left(\text{(dư)}\right)}n.M=0,018.98=1,764g\)
c. MgSO\(_4\) là muối
Theo phương trình \(n_{MgSO_4}=n_{Mg}=0,15mol\)
\(\rightarrow m_{\text{muối}}=m_{MgSO_4}=n.M=0,15.120=18g\)
d. \(H_2\) là khí
Theo phương trình \(n_{H_2}=n_{Mg}=0,15mol\)
\(\rightarrow V_{H_2\left(ĐKTC\right)}=n.22,4=0,15.22,4=3,36l\)