Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) nZn= 13/65 = 0,2 (mol)
Zn + 2HCl → ZnCl2 +H2
0,2 →0,4
mHCl= 0,4. 36,5=14,6(gam)
b) nH2=0,4/2 =0,2 (mol)
mZn= 0,2 .65=13 (g)
mHCl = 0,4.36,5 =14,6(gam)

\(Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\ n_{ZnCl_2}=n_{Zn}=0,1\left(mol\right)\\ \Rightarrow m_{ZnCl_2}=0,1.136=13,6\left(g\right)\)

Ta có: \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
____0,2_____0,4_____0,2____0,2 (mol)
a, \(V_{H_2}=0,2.24,79=4,958\left(l\right)\)
b, mZnCl2 = 0,2.136 = 27,2 (g)
c, Đề cho VTT > VLT nên bạn xem lại đề nhé.

a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Ta có: \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,2\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b, Theo PT: \(n_{HCl}=2n_{Zn}=0,4\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,4.36,5=14,6\left(g\right)\)

a, \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
_____0,2____0,4___________0,2 (mol)
\(\Rightarrow m_{HCl}=0,4.36,5=14,6\left(g\right)\)
b, \(V_{H_2}=0,2.24,79=4,958\left(l\right)\)
c, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
____________0,2__2/15 (mol)
\(\Rightarrow m_{Fe}=\dfrac{2}{15}.56=\dfrac{112}{15}\left(g\right)\)
Số mol của 13 gam Zn:
\(n_{Zn}=\dfrac{m}{M}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
1 : 2 : 1 : 1 (g)
0,2\(\rightarrow\) 0,4 : 0,2 : 0,2 (mol)
a,Khối lượng của 0,4 mol HCl:
\(m_{HCl}=n.M=0,4.36,5=14,6\left(g\right)\)
b, Thể tích khí H2:
\(V_{H_2}=n.24,79=0,2.24,79=4,958\left(l\right)\)
\(3H_2+Fe_2O_3\underrightarrow{t^o}2Fe+3H_2O\)
Khối lượng của \(\dfrac{2}{15}\) mol Fe:
\(n_{Fe}=\dfrac{m}{M}=\dfrac{2}{\dfrac{15}{56}}\approx7,5\left(g\right)\)

\(n_{HCl}=\dfrac{7,3}{36,5}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,1<---0,2------>0,1--->0,1
=> mZn = 0,1.65 = 6,5(g)
=> VH2 = 0,1.22,4 = 2,24(l)
=> mZnCl2 = 0,1.136 = 13,6(g)

PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
___0,3____0,6_____0,3____0,3 (mol)
a, \(m_{Zn}=0,3.65=19,5\left(g\right)\)
b, \(m_{HCl}=0,6.36,5=21,9\left(g\right)\)
c, \(m_{ZnCl_2}=0,3.136=40,8\left(g\right)\)
Bạn tham khảo nhé!

a. \(n_{Zn}=\dfrac{19.5}{65}=0,3\left(mol\right)\)
\(n_{HCl}=\dfrac{14.6}{36.5}=0,4\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
0,4 0,2 0,2
Ta thấy : \(\dfrac{0.3}{1}>\dfrac{0.4}{2}\) => Zn dư , HCl đủ
b. \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
c. \(m_{ZnCl_2}=0,2.136=27,2\left(g\right)\)
a) Zn + 2HCl --> ZnCl2 + H2 ↑ (1)
0,3 -->0,15 -->0,15 (mol)
nZn= 19,5/65 = 0,3 mol
nHCl= 14,5/37,5 = 0,3 mol
Ta có : nZn bài ra / nZn phương trình=0,3/1=0,3 (mol)
nHCl bài ra / nHCl phương trình=0,3/2=0,15 (mol)
=> HCl đủ,Zn dư
b) Theo PT(1) => nH2=0,15(mol)
=>VH2=0,15 x 22,4 = 3,36(l)
c) Theo PT(1) => nZnCl2=0,15(mol)
=>mZnCl2=0,15 x 136 = 20,4(g)

\(nZn=\dfrac{6,5}{65}=0,1mol\)
PTHH:
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
0,1--->0,2------->0,2------>0,1
a, \(VH_2=0,1.22,4=2,24lít\)
b, \(mHCl=0,2.36,5=3,65g\)
c, cách 1:
\(mZnCl_2=0,2.136=27,2gam\)
cách 2 :
\(mH_2=0,1.2=0,2gam\)
BTKL: mZn+mHCl=mZnCl2+H2
6,5+3,65 =mZnCl2+0,2
sao cái cách 2 btkl mình cs tính kq mà s nhìn nó lạ lắm
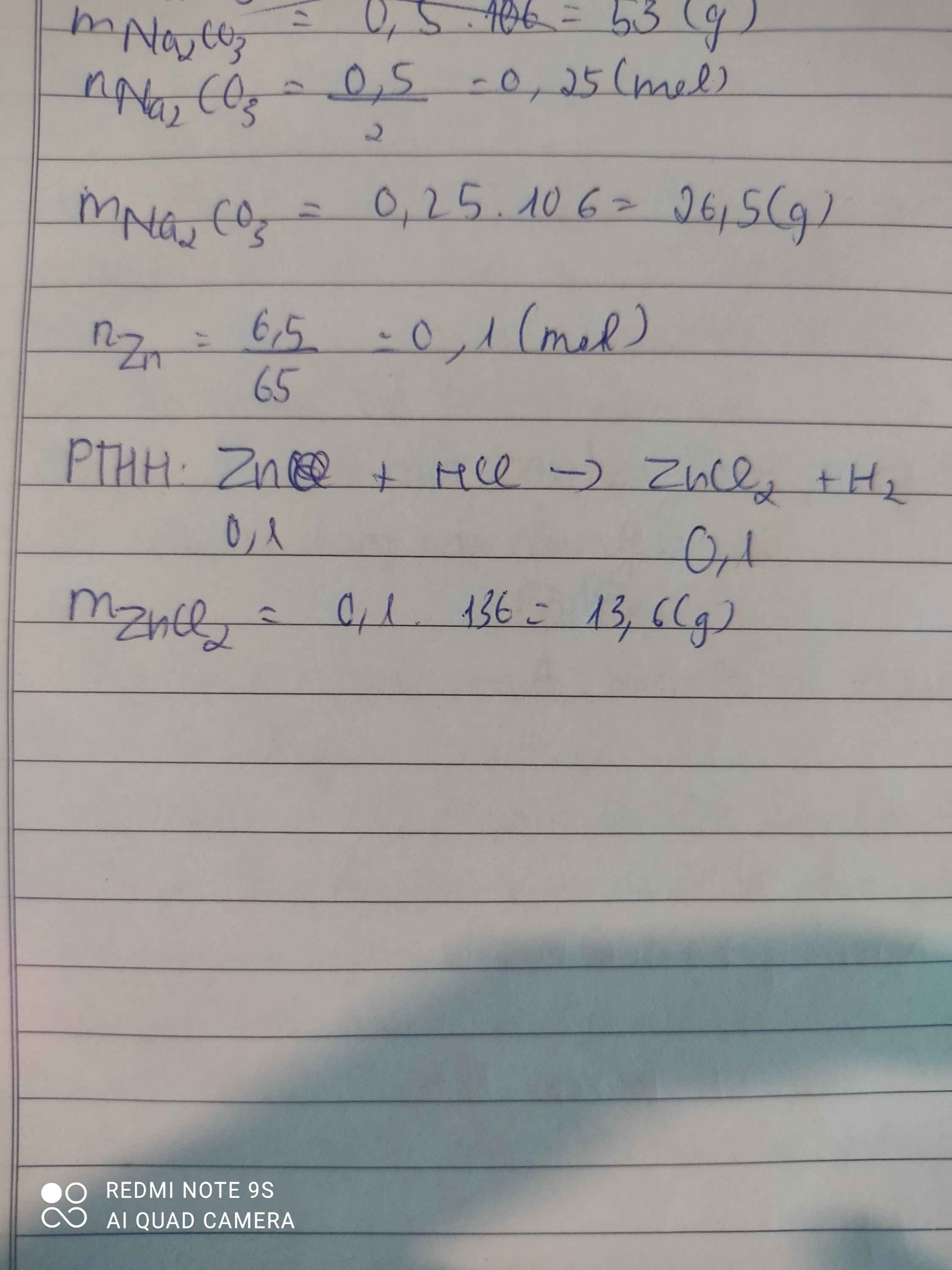
\(n_{H_2} = \dfrac{V_{H_2}}{24,79} = \dfrac{7,437}{24,79} = 0,3 \text{ (mol)}\)
PTHH: \(Zn + 2HCl \rightarrow ZnCl_2 + H_2\)
Theo PT: 1 : 1 (mol)
\(n_{Zn} = n_{H_2} = 0,3 \text{ (mol)}\)
Kl của Zn đã tham gia pứ: \(m_{Zn} = n_{Zn}.M_{Zn} = 0,3.65=19,5 \text{ (g)}\)
`\Rightarrow D.`
Để giải bài toán này, ta sẽ sử dụng định lý Avogadro và các phương trình hóa học. Cụ thể, ta sẽ áp dụng các bước sau:
Phương trình hóa học:
Zn+2HCl→ZnCl2+H2Zn+2HCl→ZnCl2+H2
Bước 1: Tính số mol của khí H₂
Ta biết rằng khí H₂ ở điều kiện tiêu chuẩn (đkc) có thể được tính bằng công thức: �H2=�H222,4 L/molnH2=22,4 L/molVH2
Trong đó:
Áp dụng vào công thức:
�H2=7,43722,4≈0,332 molnH2=22,47,437≈0,332 molBước 2: Tính số mol của Zn
Từ phương trình phản ứng, ta thấy rằng 1 mol Zn phản ứng với 1 mol H₂. Vậy số mol Zn tham gia phản ứng sẽ bằng số mol H₂:
�Zn=�H2=0,332 molnZn=nH2=0,332 molBước 3: Tính khối lượng của Zn
Khối lượng của Zn tham gia phản ứng được tính theo công thức:
�Zn=�Zn×�ZnmZn=nZn×MZnTrong đó:
Vậy:
�Zn=0,332×65,4≈21,7 gammZn=0,332×65,4≈21,7 gamKết quả:
Khối lượng Zn tham gia phản ứng gần nhất với đáp án là 19,5 gam. Do đó, đáp án đúng là D. 19,5 gam.