Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Đặt x và y lần lượt là số mol O3 và O2 trong hỗn hợp
2O3 → 3O2
Trước phản ứng : (x + y) mol hỗn hợp
Sau phản ứng: (x+ 3/2y) mol
Số mol tăng là: (x+ 3/2y) - (x +y) = 0,5y.
b) Ta có; 0,5y ứng với 2% nên y ứng với 4%
vậy O3 chiếm 4%, O2 chiên 96%.

= 39,985.
22,4 lít Ar ở đktc có khối lượng 39,985 g
x lít Ar ở đktc có khối lượng 10 g
=> x= 5,602 lít

Các bạn ơi giúp mình với. Chuyên đề này sáng mai mình phải nộp rồi! Cảm ơn các bạn nhiều!


Đặt x và y lần lượt là số mol của O2 và O3 trong hỗn hợp
2O3 -> 3O2
y 1,5y
Trước phản ứng (x + y) mol hỗn hợp.
Sau phản ứng (x + 1,5y) mol.
Số mol tăng là (x + 1,5y) – (x + y) = 0,5y.
b) 0,5y tương ứng với 2% => y tương ứng với 4%.
Vậy thành phần phần trăm khí oxi là 96% và ozon là 4%.

1. a. dd KI xuất hiện màu đỏ tím, sau đó dần trở lại không màu
Cl2 + 2KI \(\rightarrow\) 2KCl + I2 và 5Cl2 + I2 + 6H2O \(\rightarrow\) 2HIO3 + 10HCl
b. Quá trình chuyển X2 \(\rightarrow\) 2X- phụ thuộc vào 2 yếu tố: năng lượng phân li phân tử thành nguyên tử (tức năng lượng liên kết) và ái lực e để biến nguyên tử X thành ion X-
Mặc dù ái lực của flo bé hơn clo, nhưng năng lượng liên kết của flo lại thấp hơn của clo nên flo dễ phân li thành nguyên tử hơn, vì vậy tính oxi hóa của flo mạnh hơn clo
(Năng lượng liên kết của flo thấp hơn clo vì: Trong phân tử F chỉ có các AO p, không có AO trống \(\rightarrow\) phân tử F2 chỉ có liên kết \(\sigma\). Trong nguyên tử Cl, ngoài các AO p còn có AO d trống \(\rightarrow\) phân tử Cl2 ngoài sự xen phủ các AO p để tạo liên kết \(\sigma\), thì mây e còn đặt vào AO d trống, do đó tạo một phần liên kết pi).
2. Dựa vào thể tích và khối lượng hỗn hợp khí, lập hệ pt dễ dàng tính được số mol SO2 = 0,06 và NO2 = 0,02 \(\rightarrow\) số mol e nhận = 0,06.2 + 0,02 = 0,14
Nếu tất cả kim loại đều tan thì ne nhường = 0,03.3 + 0,02.2 + 0,02.2 = 0,17 > 0,14. Như vậy có kim loại còn dư, đó là Cu (vì Cu có tính khử yếu nhất), tính được số mol Cu dư = \(\frac{0,17-0,14}{2}\) = 0,015
Ta có : NO3- + 2H+ +1e \(\rightarrow\) NO2 + H2O
0,02 0,04
SO42- +4H+ +2e \(\rightarrow\) SO2 +2H2O
0,06 0,24
nNO3 -(muối) = nNO3- (ax) – nNO2 = nH+ - nNO2 = 0,04 – 0,02 = 0,02
Tương tự tính được nSO42- = 0,06 mol. Khối lượng muối = mkim loại + mgốc axit
\(\rightarrow\) m = 0,03.27 + 0.02.65 + 0,005.64 + 0,02.62 + 0,06.96 = 9,43 (gam)

a)Fe + 2HCl ->FeCl2 + H2\(\uparrow\)
0.01 0.01
FeS + 2HCl ->FeCl2 + H2S\(\uparrow\)
0.1 0.1
H2S + Pb(NO3)2->PbS \(\downarrow\) + 2HNO3
0.1 0.1
nPbS =2.39/239=0.1 mol , n (hỗn hợp khí) =2.464/22.4=0.11 mol
n(H2)+n(H2S)=0.11 ->n(H2)=0.01 mol
V(H2)=n * 22.4 = 0.01*22.4=0.224(l)
V(H2S)=n*22.4=0.1*22.4=2.24(l)
m(Fe)=n*M=0.01*56=0.56(g)
m(FeS)=n*M=0.1*88=8.8(g)

1.
a/ - Cho dd H2SO4 loãng t/d với Fe.
Fe + H2SO4 -> FeSO4 + H2O
=> H2SO4 có tính chất hóa học (tchh) của axit: t/d với KL đứng trước H sinh ra muối và khí H2.
- Cho dd H2SO4 l~t/d với CuO.
CuO + H2SO4 -> CuSO4 + H2O
=> H2SO4 có tchh của axit: t/d với oxit bazơ tạo ra muối và nước.
- Cho dd H2SO4 t/d với KOH.
2KOH + H2SO4 -> K2SO4 + 2H2O
=> H2SO4 có tchh của axit: t/d với dd kiềm cho ra muối và nước.
b/ - Cho H2SO4 đặc t/d với Cu.
Cu + 2H2SO4 đ --t*--> CuSO4 + SO2 + 2H2O
=> H2SO4 đặc có tchh riêng: t/d được với Cu, sinh ra khí SO2 (KL đứng sau H).
- Cho H2SO4 đặc t/d với Fe.
2Fe + 6H2SO4 đ --t*--> Fe2(SO4)3 + 6H2O + 3SO2
=> H2SO4 đặc có tchh riêng: t/d với KL sinh ra muối và giải phóng SO2; đẩy được Fe lên hóa trị cao nhất.
- Cho H2SO4 đặc vào C6H12O6.
C6H12O6 ----H2SO4 đ, t*---> 6C + 6H2O
=> H2SO4 đặc có tchh riêng: có tính háo nước.
2. Gọi số mol của CuO và ZnO lần lượt là a và b.
n HCl = Cm.V = 3.0,1 = 0,3 mol.
a/ CuO + 2HCl -> CuCl2 + H2O
_1_____2 (mol)
_a_____2a
ZnO + 2HCl -> ZnCl2 + H2O
_1______2 (mol)
_b_____2b
Theo đề bài, ta có hệ phương trình:
80a + 81b = 12,1 (m hh)
2a + 2b = 0,3 (n HCl)
Giải hệ, được: a = 0,05; b = 0,1.
b/ m CuO = n.M = 80a = 80.0,05 = 4 (g).
=> % mCuO = (mCuO / mhh) . 100% = 33,06 %.
=> % mZnO = 100% - 33,06% = 66,94 %.
c/ CuO + H2SO4 -> CuSO4 + H2O
___1______1 (mol)
___0,05__0,05
ZnO + H2SO4 -> ZnSO4 + H2O
_1_____1 (mol)
_0,1__0,1
Tổng số mol H2SO4 = 0,05 + 0,1 = 0,15 mol.
=> m H2SO4 = n.M = 0,15.98 = 14,7 g.
=> mdd H2SO4 = (mct.100%) / C% = (14,7.100)/20 = 73,5 g.
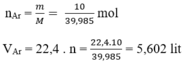
 Giúp mình câu 9 10 11 12 với gấp lắm :((
Giúp mình câu 9 10 11 12 với gấp lắm :((
Nguyên tử khối trung bình của agon là :
Ở điều kiện tiêu chuẩn, 1 mol agon tức là 39,98 g chiếm thể tích là 22,4 lít.
Vậy thể tích của 20 gam agon là : 22,4.20/39,98 = 11,2 l