
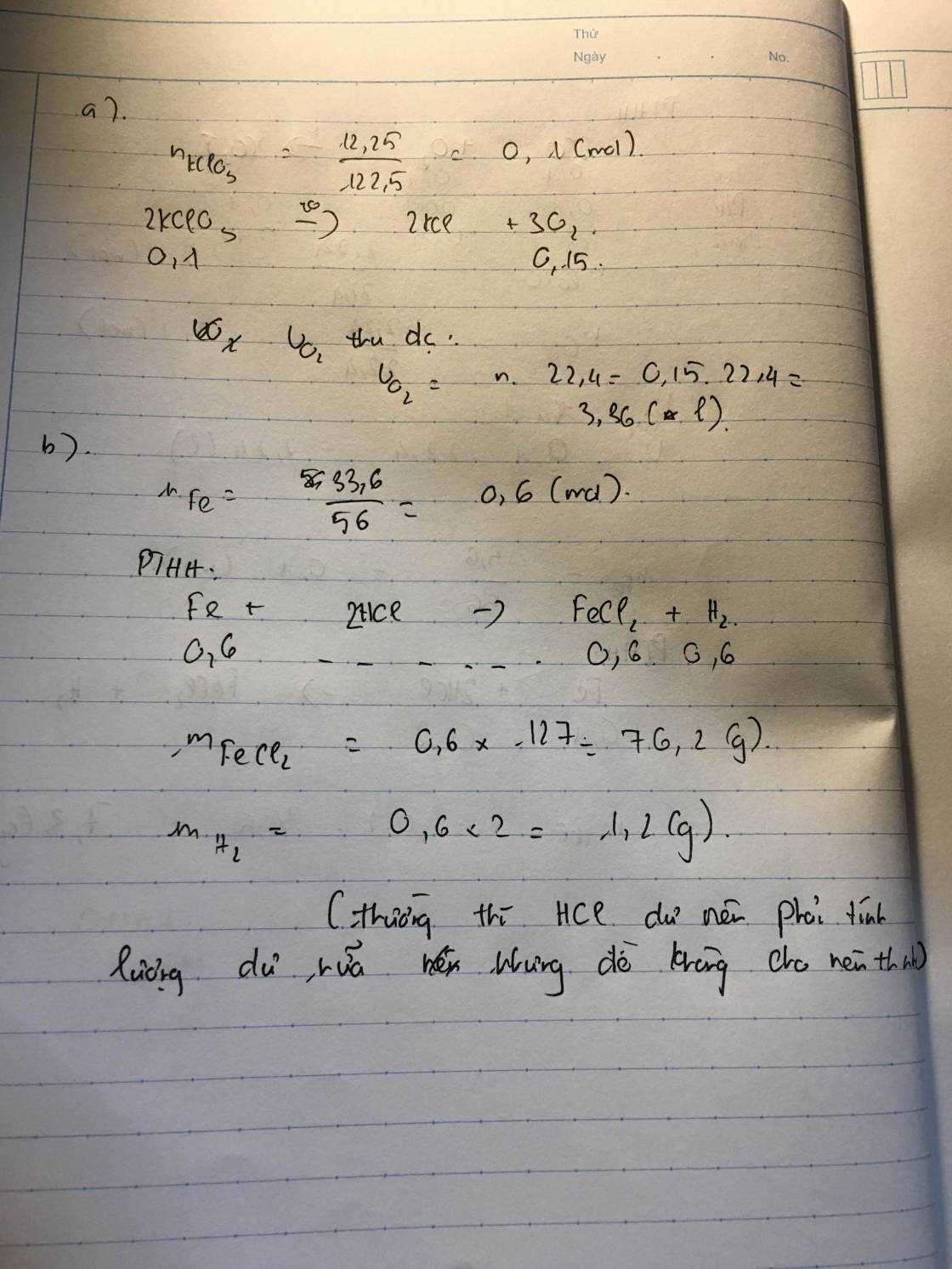
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

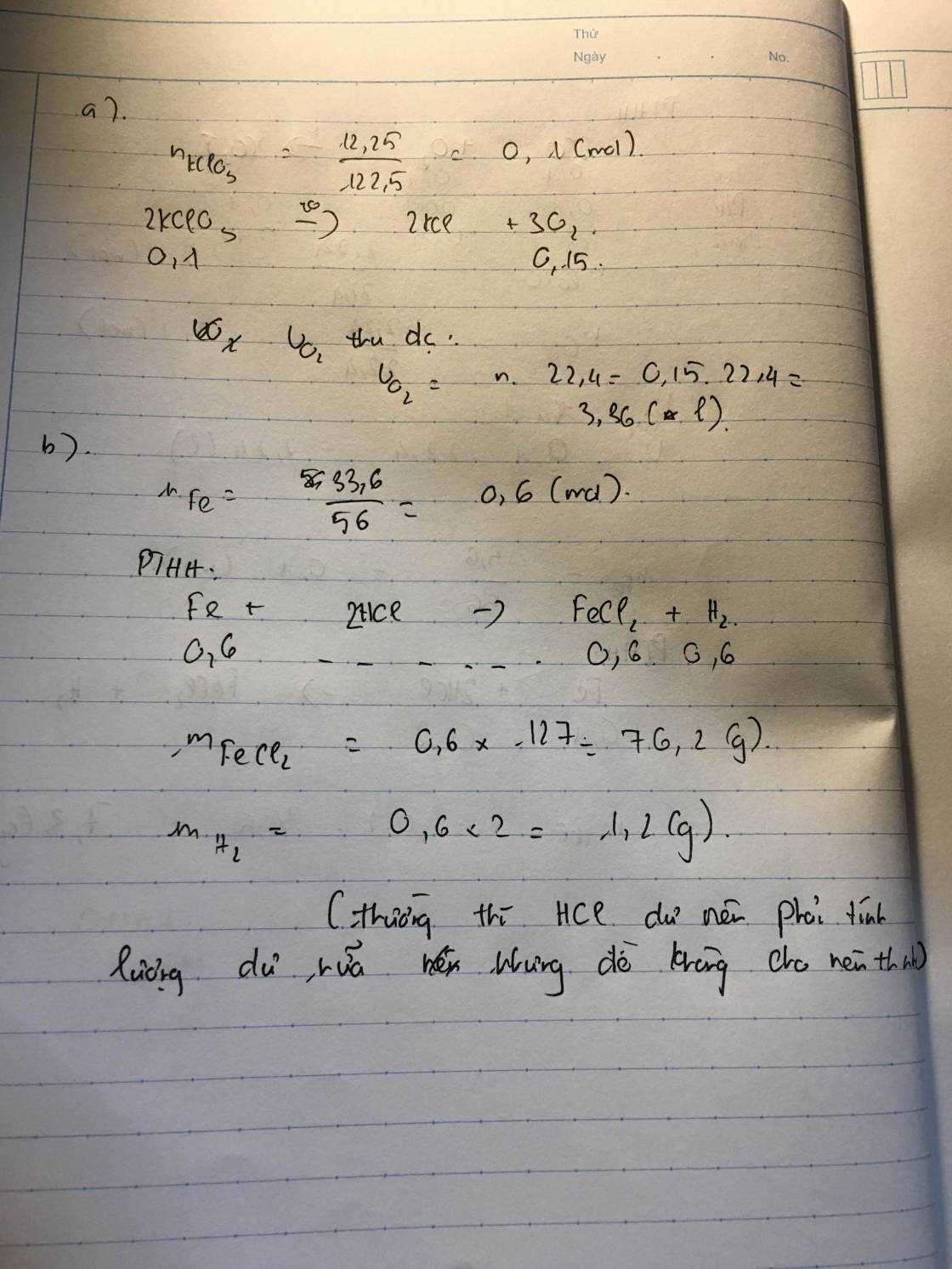

a, PTHH:
H2 + ZnO → Zn + H2O
nZnO = 8,1 / 81 = 0,1 ( mol)
Thep PTHH nH2 = nZnO = 0,1( mol)
nzn = nZnO = 0,1 (mol)
VH2 = 0,1 x 22,4 = 2,24 (l)
b, mZn = 0,1 x 65 = 6,5 (g)
c, Zn + 2HCl → ZnCl2 + H2
mHCl = 200 x 7,3 % = 14,6 ( g)
nHCl = 14,6 / 36,5 = 0,4 ( mol)
Theo PTHH nH2 = 1/2nHCl= 0,4 /2 = 0,2( mol)
VH2 = 0,2 x 22,4 = 4,48( l)
d, y H2 + FexOy → x Fe + yH2O
Theo câu a nH2 = 0,1 ( mol)
Theo PTHH nFexOy= 1/ynH2 = 0,1 /y ( mol)
mFexOy = 0,1/y( 56x + 16y)= 3,24 (g)
đoạn này bạn tự tính nhé!

Bài 1:
\(n_{C_4H_{10}}=\frac{m}{M}=\frac{11,6}{58}=0,2mol\)
PTHH: \(2C_4H_{10}+13O_2\rightarrow^{t^o}8CO_2\uparrow+10H_2O\)
0,2 1,3 0,8 1 mol
\(\rightarrow n_{O_2}=n_{C_4H_{10}}=\frac{13.0,2}{2}=1,3mol\)
\(V_{O_2\left(ĐKTC\right)}=n.22,4=1,3.22,4=29,12l\)
\(\rightarrow n_{CO_2}=n_{C_4H_{10}}=\frac{8.0,2}{2}=0,8mol\)
\(m_{CO_2}=n.M=0,8.44=35,2g\)
\(\rightarrow n_{H_2O}=n_{C_4H_{10}}=\frac{10.0,2}{2}=1mol\)
\(m_{H_2O}=n.M=1.18=18g\)

1.
- nFe= \(\dfrac{11,2}{56}\) = 0,2 mol
nAl = \(\dfrac{m}{27}\) mol
- Khi thêm Fe vào cốc đựng dd HCl (cốc A) có phản ứng:
Fe + 2HCl \(\rightarrow\) FeCl2 +H2 \(\uparrow\)
0,2 0,2
- Theo định luật bảo toàn khối lượng, khối lượng cốc đựng HCl tăng thêm:
11,2 - (0,2.2) = 10,8g
- Khi thêm Al vào cốc đựng dd H2SO4 có phản ứng:
2Al + 3 H2SO4 \(\rightarrow\) Al2 (SO4)3 + 3H2\(\uparrow\)
\(\dfrac{m}{27}\) mol \(\rightarrow\) \(\dfrac{3.m}{27.2}\)mol
- Khi cho m gam Al vào cốc B, cốc B tăng thêm m - \(\dfrac{3.m}{27.2}\)
- Để cân thăng bằng, khối lượng ở cốc đựng H2SO4 cũng phải tăng thêm 10,8g. Có: m - \(\dfrac{3.m}{27.2}.2\) = 10,8
- Giải được m = (g)
2.
PTPƯ: CuO + H2 \(\underrightarrow{400^oC}\) Cu + H2O
Nếu phản ứng xảy ra hoàn toàn, lượng Cu thu được \(\dfrac{20.64}{80}=16g\)
16,8 > 16 => CuO dư.
Hiện tượng PƯ: Chất rắn dạng bột CuO có màu đen dần dần chuyển sang màu đỏ (chưa hoàn toàn).
Đặt x là số mol CuO PƯ, ta có mCR sau PƯ = mCu + mCuO còn dư
= mCu + (mCuO ban đầu – mCuO PƯ)
64x + (20-80x) =16,8 \(\Leftrightarrow\) 16x = 3,2 \(\Leftrightarrow\) x= 0,2.
nH2 = nCuO= x= 0,2 mol. Vậy: VH2= 0,2.22,4= 4,48 lít
3.
2KClO3 \(\rightarrow\) 2KCl + 3O2
\(\dfrac{a}{122,5}\) \(\rightarrow\) \(\dfrac{a}{122,5}\left(74,5\right)\) + \(\dfrac{3a}{2}.22,4\)
2KMnO4 \(\rightarrow\) K2MnO4 + MnO2 + O2
\(\dfrac{b}{158}\) \(\rightarrow\) \(\dfrac{b}{2.158}197\) + \(\dfrac{b}{2.158}87\) + \(\dfrac{b}{2}22,4\)
\(\dfrac{a}{122,5}74,5=\dfrac{b}{2.158}197+\dfrac{b}{2.158}87\)
\(\dfrac{a}{b}=\dfrac{122,5\left(197+87\right)}{2.158.74,5}\approx1,78\)
\(\dfrac{3a}{2}.22,4:\dfrac{b}{2}.22,4=3\dfrac{a}{b}\approx4,43\)

1.Đem nung 69, 52 g thuốc tím (KMnO4) chứa 10% tạp chất trơ, thu được muối K2MnO4; MnO2 và khí O (đktc)
a. Tính khối lượng muối sinh ra
\(2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2\) ( thêm nhiệt độ )
\(n_{KMnO_4}=\dfrac{m}{M}=\dfrac{69,52}{158}=0,44\left(mol\right)\)
Theo PTHH :
\(n_{KMnO_4}=2.n_{K_2MnO_4}=2.0,44=0,88\left(mol\right)\)
\(\Rightarrow m_{K_2MnO_4}=n.M=0,88.197=137,36\left(g\right)\)
b. Tính khối lượng MnO2 sinh ra
Theo PTHH :
\(n_{KMnO_4}=2.n_{MnO_2}=2.0,44=0,88\left(mol\right)\)
\(\Rightarrow m_{MnO_2}=n.M=0,88.87=76,56\left(g\right)\)
c. Tính thể tích oxi sinh ra.
Theo PTHH :
\(n_{KMnO_4}=2.n_{O_2}=2.0,44=0,88\left(mol\right)\)
\(\Rightarrow V_{O_2}=n.22,4=0,88.22,4=19,712\left(l\right)\)
2. Đốt cháy 16,8 g Fe trong bình chứa 17,92 lít khí O2 (đktc).
a. Chất nào còn dư? Khối lượng dư là bao nhiêu?
\(n_{Fe}=\dfrac{m}{M}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
\(n_{O_2}=\dfrac{V}{22,4}=\dfrac{17,92}{22,4}=0,8\left(mol\right)\)
PTHH : \(3Fe+2O_2\rightarrow^{t^0}Fe_3O_4\)
Theo PTHH : 3 mol 2 mol
Theo bài : 0,3 mol 0,8 mol
Tỉ lệ : \(\dfrac{0,3}{3}< \dfrac{0,8}{2}\)
=> O2 dư
Theo PTHH : \(n_{O_2}=\dfrac{2}{3}n_{Fe}=\dfrac{2}{3}.0,3=0,2\left(mol\right)\)
\(\Rightarrow m_{O_2}=0,2.32=6,4\left(g\right)\) ( khối lượng O2 phản ứng )
\(m_{O_2bđ}=0,8.32=25,6\left(g\right)\)
\(\Rightarrow m_{O_2dư}=m_{O_2bđ}-m_{O_2pu}=25,6-6,4=19,2\)( g )
b. Sản phẩm thu được là chất nào? Khối lượng bao nhiêu?
Sản phẩm thu được là \(Fe_3O_4\)
Theo PTHH :
\(n_{Fe_3O_4}=\dfrac{1}{3}n_{Fe}=\dfrac{1}{3}.0,3=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe_3O_4}=n.M=0,1.232=23,2\left(g\right)\)

1)
PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
a. \(n_{Zn}=\frac{m}{M}=\frac{13}{65}=0,2mol\)
\(n_{HCl}=\frac{m}{M}=\frac{18,25}{36,5}=0,5mol\)
Lập tỷ lệ \(\frac{n_{Zn}}{1}\) và \(\frac{n_{HCl}}{2}\rightarrow\frac{0,1}{1}< \frac{0,5}{2}\)
Vậy sau phản ứng HCl còn dư nên tính theo số mol Zn
\(\rightarrow n_{Zn}=n_{H_2}=0,2mol\)
\(\rightarrow V_{H_2}=0,2.22,4=4,48l\)
b. Sau phản ứng thì nhúng dung dịch vào quỳ tím, làm cho quỳ tím hoá đỏ bởi còn HCl dư
c. PTHH: \(CuO+H_2\rightarrow^{t^o}Cu+H_2O\)
Trước pứ: 0,3 0,2 mol
pứ: 0,2 0,2 mol
Sau pứ: 0,1 0,2 mol
Vậy sau pứ thu được X gồm CuO dư và Cu
\(\rightarrow m_X=m_{CuO\left(dư\right)}+m_{Cu}=0,1.80+0,2.64=20,8g\)
2)
Đặt \(a\left(g\right)=m_{Na}=m_{Fe}=m_{Al}\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\left(1\right)\)
\(2Na+2HCl\rightarrow2NaCl+H_2\left(2\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\left(3\right)\)
Có \(\hept{\begin{cases}n_{Fe}=a/56mol\\n_{Al}=a/27mol\\n_{Na}=a/23mol\end{cases}}\)
Theo phương trình \(n_{H_2}\left(1\right)=\frac{3}{2}n_{Al}=\frac{a}{18}mol\)
\(n_{H_2}\left(2\right)=\frac{1}{2}n_{Na}=\frac{a}{46}mol\)
\(n_{H_2}\left(3\right)=n_{Fe}=\frac{a}{56}mol\)
\(\frac{a}{18}\approx0,056a\left(mol\right)\)
\(\frac{a}{46}\approx0,22a\left(mol\right)\)
\(\frac{a}{56}\approx0,018a\left(mol\right)\)
Xét \(0,018a< 0,22a< 0,056a\)
Vậy Al cho thể tích \(H_2\) là nhiều nhất.
sao ngọc nam chưa nổi 1000 điểm mà được làm cộng tác viên rồi

a) MnO2 + 4HCl \(\rightarrow\) MnCl2 + Cl2 + H2O
Ta có: nHCl=\(\frac{7,3}{36,5}\)=0,2 mol \(\rightarrow\)nCl2=0,2.\(\frac{1}{4}\)=0,05 mol
\(\rightarrow\)VCl2=0,05.22,4=1,12 lít
b) 2KMnO4 + 16HCl\(\rightarrow\) 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Theo ptpu: nCl2=\(\frac{5}{16}\)nhCl=\(\frac{5}{16}\).0,2=0,0625 mol
\(\rightarrow\)V Cl2=0,0625.22,4=1,4 lít

a, nCaCO3=10/100=0,1 mol
PTHH: CaCO3+2HCl---> CaCl2+CO2+H2O
Theo pthh ta có: nCaCl2=nCaCO3=0,1 mol
=> mCaCl2=0,1.111=11,1 (g)
b, nCaCO3=5/100=0,05 mol
Theo pthh ta có : nCO2=nCaCO3=0,05 mol
=> VO2(điều kiện phòng)= 0,05.24= 1,2 l
a) Số mol canxi cacbonat tham gia phản ứng
=
= 0,1 mol
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Theo phương trình hóa học, ta có:
=
= 0,1 mol
Khối lượng của canxi clotua tham gia phản ứng:
= 0,1 . (40 + 71) = 11,1 g
b) Số mol canxi cacbonat tham gia phản ứng:
=
= 0,05 mol
Theo phương trình hóa học, ta có:
=
= 0,05 mol
Thể tích khí CO2 ở điều kiện phòng là:
= 24 . 0,05 = 1,2 lít