Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
- Dung dịch X:
HCl → H+ + Cl-
0,04M → 0,04M
→ [H+] = 0,04M
→ pH = -log[H+] = -log(0,04) ≈ 1,4
- Dung dịch Y:
NaOH → Na+ + OH-
0,02M ______0,02M
Ba(OH)2 → Ba2+ + 2OH-
0,01M_________0,02M
→ [OH-] = 0,02 + 0,02 = 0,04M
→ pOH = -log[OH-] = -log(0,04) ≈ 1,4
→ pH = 14 - pOH = 14 - 1,4 ≈ 12,6
b)
300 ml X có: nH+ = nHCl = 0,3.0,04 = 0,012 mol
200 ml Y có: nOH- = nNaOH + 2nBa(OH)2
= 0,2.0,02 + 2.0,2.0,01 = 0,008 mol
PT ion: H+ +OH- → H2O
Bđ:__0,012__0,008
Pư: __0,008__0,008
Sau:__0,004 ___0
→ [H+] =\(\frac{0,004}{0,3+0,2}\) = 0,008M
→ pH = -log(0,008) ≈ 2,1

nHCl =0,002 mol
nH2SO4 = 0,001 mol
=> n[H+] = 0,002+0,002=0,004 mol
V dd =0,3 l
=> p[H+]=1,88

Đáp án D
nH2SO4 = 0,005 .0,25 =0,00125(mol)
nHCl = 0,01. 0,25= 0,0025 (mol)
∑n= 0,00125 + 0,0025= 0,00375 (mol)
∑n= 0,001.0,2 + 0,0005.2.0,2=0,0004
H+ + OH- → H2O
Ban đầu: 0,00375 0,0004
Phản ứng: 0,0004 0,0004
Sau phản ứng: 0,00335 0
Vsau = 0,2 + 0,25= 0,45(lít)
Mà 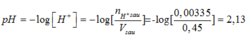

nBa(OH)2 = 0,25 x mol; nOH-= 0,5x mol
nH+ = 0,025 mol, nSO4(2-) = 0,0025 mol
H++ OH- → H2O
0,025 0,025 mol
Dung dịch sau phản ứng có pH = 12 nên OH- dư
nOH- dư = 0,5x- 0,025
[OH-] dư = nOH- dư/ Vdd = (0,5x- 0,025)/0,5 =10-2 suy ra a = 0,06 M
Ba2++ SO42- → BaSO4
0,015 0,0025 0,0025 mol
mBaSO4 = 0,5825 gam