Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) PTHH:
CuO + H2 =(nhiệt)=> Cu + H2O (1)
Fe2O3 + 3H2 =(nhiệt)=> 2Fe + 3H2O (2)
b) - Dựa vào định nghĩa chất khử và chất oxi hóa
=> Chất khử: H2
Chất Oxi hóa: CuO và Fe2O3
c) Lượng đồng có trong 6g hỗn hợp 2 kim loại thu được:mCu = 6g - 2,8g = 3,2g.
VH2 cần dùng theo phương trình phản ứng(1) = \(\dfrac{3,2}{64}\cdot64=1,12\left(l\right)\) =
VH2 cần dùng theo phương trình phản ứng(2) = \(\dfrac{2,8}{56}\cdot\dfrac{3}{2}\cdot22,4=1,68\left(l\right)\)
a.Phương trình phản ứng:
CuO + H2 Cu + H2O (1)
1mol 1mol 1mol 1mol
Fe2O3 + 3H2 3H2O + 2Fe (2)
1mol 3mol 3mol 2mol
b. + Chất khử là H2 vì chiếm oxi của chất khác;
+ Chất oxi hóa: CuO, Fe2O3 vì nhường oxi cho chất khác.
c. Số mol đồng thu được là: nCu = = 0,5 (mol)
Số mol sắt là: nFe = = 0,05 (mol)
Thể tích khí H2 cần dùng để khử CuO theo phương trình phản ứng (1) là: nH2 = nCu = 0,05 mol => VH2 = 22,4.0,05 = 1,12 (lít)
Khí H2 cần dùng để khử Fe2O3 theo phương trình phản ứng (2) là:
nH2 = nFe =
.0,05 = 0,075 mol
=>VH2(đktc) = 22,4.0,075 = 1,68 (lít)

a) Phương trình hóa học của các phản ứng:
H2 + CuO → Cu + H2O (1).
3H2 + Fe2O3 → 2Fe + 3H2O (2).
b) Trong phản ứng (1), (2) chất khử H2 vì chiếm oxi của chất khác, chất oxi hóa là CuO và Fe2O3 vì nhường oxi cho chất khác.
c) Khối lượng đồng thu được từ 6g hỗn hợp 2 kim loại thu được:
mCu = 6g - 2,8g = 3,2g, nCu = 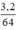 = 0,05 mol
= 0,05 mol
nFe = 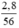 = 0,05 (mol)
= 0,05 (mol)
nH2 (1) = nCu = 0,05 mol ⇒ VH2(1) = 22,4 . 0,05 = 1,12 lít
nH2 (2) = 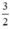 . nFe =
. nFe = 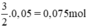 ⇒ VH2 (2) = 22,4 . 0,075 = 1,68 lít khí H2.
⇒ VH2 (2) = 22,4 . 0,075 = 1,68 lít khí H2.
VH2 = VH2(1) + VH2(2) = 1,12 + 1,68 = 2,8(l)

CuO+H2-t0-> Cu +H2O
Fe2O3+3H2-t0->2Fe+3H2O
chất khử là H2
chất oxi hóa là CuO và Fe2O3. vì chất khử là chất chiếm oxi của chất khác, còn chất oxi hóa là chất nhường oxi cho chất khác
theo đề bài ->mFe=2,8 g->nFe=0,05 mol
=>mCu=6-2,8=3,2 g->nCu=0,05mol
theo PTPỨ =>nCu=nH2=0,05 mol
3nH2=2nFe->nH2=(2/3)*0,05=1/30 mol
do đó VH2 phản ứng là: (0,05+1/30)*22,4=1,867 lít
câu 2
a)Zn+H2SO4->ZnSO4+H2
2Al+3H2SO4->Al2(SO4)3+3H2
Fe+H2SO4->FeSO4+H2
b) Fe
cậu chỉ cần đặt a là số gam của từng kim loai.(vì khối lượng của mỗi kim loại bằng nhau). Sau đó theo phương trình cậu tính khối lượng khí H2 ở mỗi phương trình rồi so sánh là được
c) Fe cách tính gần giống phần b nên tự logic nha

1. Tính khối lượng chất tham gia và sản phẩm
* Các bước giải:
- Đổi số liệu đầu bài. Tính số mol của chất mà đầu bài cho.
- Lập phương trình hoá học.
- Dựa vào số mol chất đã biết để tính số mol chất cần tìm.
2. Tính thể tích khí tham gia và tạo thành
H2+Cl2->2HCl
\(n_{H_2}=67,2:22,4=3\left(mol\right)\)
Ta có: \(n_{H_2}=n_{Cl_2}=3\left(mol\right)\)
\(V_{Cl_2}=3.22,4=67,2l\)
\(n_{HCl}=2n_{Cl_2}=2.3=6\left(mol\right)\)
\(m_{HCl}=6.36,5=219g\)

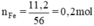
Phương trình hóa học của phản ứng:
Fe2O3 + 3H2 → 2Fe + 3H2O.
Khử 1 mol Fe2O3 cho 2 mol Fe.
x mol Fe2O3 → 0,2 mol.
x = 0,2 : 2 =0,1 mol.
m = 0,1 .160 =16g.
Khử 1 mol Fe2O3 cần 3 mol H2.
Vậy khử 0,1 mol Fe2O3 cần 0,3 mol H2.
V= 0,3 .22.4 = 6,72l.

1) Dựa vào tính không tan trong nước và nhẹ hơn không khí để thu khí bằng cách đẩy nước và đẩy không khí
2) PTHH : \(CuO + H_2 \xrightarrow{t^o} Cu + H_2O\)
3) Phản ứng thế là phản ứng hóa học mà có sự thay thế một nguyên tử hay nhóm nguyên từ này bằng nguyên tử hay nhóm nguyên tử khác.
PTHH : \(Fe + 2HCl \to FeCl_2+H_2\)
4)
Cách thu khí oxi : Ngửa ống nghiệm
Cách thu khí hidro : Úp ống nghiệm
5)
- Tác dụng với kim loại : \(Ba + 2H_2O \to Ba(OH)_2 + H_2\)
- Tác dụng với oxit bazo : \(BaO + H_2O \to Ba(OH)_2\)
- Tác dụng với oxit axit : \(SO_3 + H_2O \to H_2SO_4\)

b1: viết pthh
cl2+ h2-> 2hcl
b2: tính số mol cá chất dựa vào khối lượng hoăc thể tích đề bài cho
nH2= 67,2/224=3 mol
b3: dựa vào phương trình tính số mol các chất còn lại
theo pthh: ncl2=nh2=3 mol
nhcl=2nh2=3*2=6 mol
b4: tính khối lượng hoặc thể tích chất đề bài yêu cầu
=> Vcl2= 3*22,4=67,2l
mhcl=6* 36,5= 219g
CHÚC BẠN HỌC TỐT!

Có: nH2= 67,2:22,4=3(mol)
PTPƯ: H2 + Cl2 --to--> 2 HCl
(mol) 1 1 2
(mol) 3 3 6
(l) 67,2 67,2 134,4
(g) 6 213 219

a) PTHH: \(FeO+H_2\underrightarrow{t^o}Fe+H_2O\) (1)
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\) (2)
b) Ta có: \(\left\{{}\begin{matrix}n_{FeO}=\dfrac{7,2}{72}=0,1\left(mol\right)\\n_{Fe_2O_3}=\dfrac{23,2-7,2}{160}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_{H_2\left(1\right)}=0,1\left(mol\right)\\n_{H_2\left(2\right)}=0,3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow V_{H_2}=\left(0,1+0,3\right)\cdot22,4=8,96\left(l\right)\)
c) Ta có: \(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\) \(\Rightarrow m_{H_2}=0,25\cdot2=0,5\left(g\right)\)
Theo PTHH: \(n_{H_2O}=n_{H_2}=0,25\left(mol\right)\) \(\Rightarrow m_{H_2O}=0,25\cdot18=4,5\left(g\right)\)
Bảo toàn khối lượng: \(m_{oxit}=m_{Fe}+m_{H_2O}-m_{H_2}=15,2\left(g\right)\)
1. Giống nhau:
-Chất khí ,không màu,không mùi,không tan trong nước
Khác nhau:
Oxi nặng hơn không khí
Hóa lỏng ở nhiệt độ -180C
Hiro nhẹ hơn không khí
Hóa lỏng ở nhiệt độ-260 C
2.
PTHH:
\(2H_2+O_2\rightarrow2H_2O\)
Thuộc loại phản ứng hóa hợp
Hỗn hợp H2 và O2 theo tỉ lệ 1:2 là hỗn hợp gây nổ mạnh bởi vì:
Phản ứng tỏa nhiệt lớn và hiện tượng là có ngọn lửa hoặc lửa âm ỉ, phản ứng này diễn ra nhanh và sinh ra nhiệt lớn, do sự chênh lệnh nhiệt độ chóng vánh nên gây ra hiện tượng nổ
3.
\(H_2+CuO\underrightarrow{^{to}}Cu+H_2O\)
Trong phản ứng này H2 thể hiện tính khử, H2 đã khử đồng (II) oxit thành đồng và tạo hơi nước. Vì H2 đã chiếm chỗ của oxi trong CuO nên ta nói H2 có tính khử
4.
5.
Một số tính chất ứng dụng phổ biến của khí Hiro là:
-Dùng trong động cơ tên lửa, làm nhiên liệu thay cho những nhiên liệu như xăng, dầu.
- Do tính chất cháy sinh ra nhiều nhiệt hơn, nên thường được thay thế bởi các nguyên liệu khác
-Dùng làm đèn xì - oxi để hàn cắt kim loại ( Hidro phản ứng với Oxi tỏa nhiệt lớn)Là nguồn nguyên liệu quan trọng để sản xuất các hợp chất hữu cơ cũng như axit, amoniac
-Điều chế kim loại nhờ vào khả năng khử hợp chất oxitHidro là khí nhẹ nhất, do đó thường dùng để vận hành khinh khí cầu, sản xuất bóng bay..
4.
Có thể thu khí O2 bằng 2 cách:
+ Đẩy nước và đẩy Không khí
+ Đẩy nước: Úp ngược ống nghiệm xuống chậu nước, khi thấy khí đẩy nước ra hết khỏi ống nghiệm thì nhanh tay lật ngược ống nghiệm lên để khí khỏi bay ra ngoài.
+ Đẩy KK: Giữ ống nghiệm thẳng đứng, khi thu khí, khí O2 sẽ đẩy KK ra ngoài và trong bình chỉ còn lại O2. Ở cách này không cần úp ngược ống nghiệm vì khí O2 nặng hơn KK nên sẽ ở dưới đáy ống nghiệm. Muốn biết ống nghiệm đã đầy O2 chưa thì đốt một mảnh giấy nhỏ rồi thổi tắt mảnh giấy sao cho còn một ít đóm hồng, để mảnh giấy đó trên đầu ống nghiệm, nếu thấy mảnh giấy cháy trở lại có nghĩa là trong bình đã đầy khí O2
Có thể thu khí H2 bằng cách:
+ Đẩy nước và đẩy KK
+ Đẩy nước thì cũng úp ngược ống nghiệm xuống chậu nước, sao cho nước vô đầy ống nghiệm, khi thấy khí đẩy hết nước ra thì lấy miếng mút để vô đầu ống nghiệm, không lật ngược lên vì nếu lật ngược lên thì khí sẽ bay ra hết vì H2 nhẹ hơn KK.
+ Đẩy KK: Úp ngược ống nghiệm để thu khí