Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi số mol của C 2 H 2 có trong hỗn hợp là x → n C 3 H 8 = 5,6/22,4 - x(mol)
Ta có:
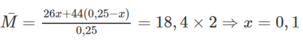
Phương trình hóa học :
C 2 H 2 + 2 Br 2 → C 2 H 2 Br 4
Vậy m Br 2 đã phản ứng là: 0,2 x 160 = 32(gam)

Thể tích khí đã tác dụng với dung dịch brom là : 6,72 - 2,24 = 4,48 (lít).
=> Số mol khí phản ứng với dung dịch brom là : 4,48/22,4 = 0,2 mol
Khối lượng bình brom tăng lên là do khối lượng hiđrocacbon bị hấp thụ. Vậy khối lượng mol phân tử của hiđrocacbon là :
5,6/0,2 = 28 (gam/mol)
=> Công thức phân tử của một hiđrocacbon là C 2 H 4
Dựa vào phản ứng đốt cháy tìm được hiđrocacbon còn lại là CH 4
% V C 2 H 4 = 4,48/6,72 x 100% = 66,67%; V CH 4 = 33,33%

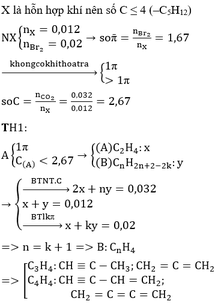
Gọi công thức của A là C a H 2 a của B là C n H 2 n - 2 với a, n > 2, số mol tương ứng cũng là x, y.
Phương trình hóa học:
C n H 2 n - 2 + 2 Br 2 → C n H 2 n - 2 Br 4
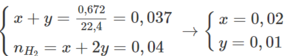
Phương trình hóa học của phản ứng cháy:
C a H 2 a + 3a/2 O 2 → a CO 2 + a H 2 O
C n H 2 n - 2 + (3n-1)/2 O 2 → n CO 2 + (n-1) H 2 O
0,2a + 0,1n = 30,8/44 = 0,7
2a + m = 7 => a = 2; n = 3
Công thức của A là C 2 H 4 của B là C 3 H 4
% V C 2 H 4 = 0,2/0,3 x 100% = 66,67%
% V C 3 H 4 = 33,33%

\(n_C=\dfrac{26,4}{44}=0,6\left(mol\right)\\ n_H=2.\dfrac{14,4}{18}=1,6\left(mol\right)\\ CTPT:C_xH_y\\ \Rightarrow x:y=3:8\\ \Rightarrow\left(C_3H_8\right)_n=44\\ \Rightarrow n=1\\ CTPT:C_3H_8\)
\(CTCT:CH_3-CH_2-CH_3\)
\(C_3H_8+Cl_2\underrightarrow{askt}C_3H_7Cl+HCl\)


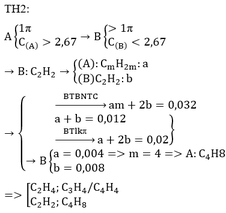
=> nX+T = 0,12
=> nCO2 – nH2O = 0,5 – 0,36 = 0,14 >nT
=> Y là axit không no
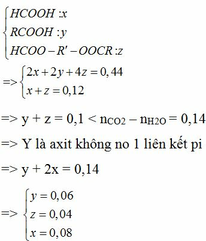
nCO2 = 1 . 0,08 + b . 0,06 + c . 0,04 = 0,5 (với b là số nguyên tử C trong Y và c là số nguyên tử C trong T)
1,5b + c = 10,5
=> 3b +2c = 21
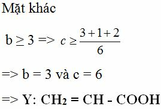
T: CH2 = CH – COO – CH2 – CH2 - OOCH