Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Trích lần lượt các chất ra ống thử
- Cho dung dịch AgNO3 vào từng mẫu thử mẫu nào xuất hiện kết tủa trắng là HCl và NaCl
HCl + AgNO3 → AgCl↓ + HNO3
NaCl + AgNO3 → AgCl↓ + NaNO3- Sau đó ta chia bốn dung dịch đó làm hai nhóm
+ Nhóm 1 : HCl ; NaCl
+ Nhóm 2 : H2SO4 ; Na2SO4
- Sau đó cho quỳ tím vào hai nhóm
+ Ở nhóm 1 : mẫu thử nào làm quỳ tím hóa đỏ là HCl còn lại là NaCl
+ Ở nhóm 2 : mẫu thử nào làm quỳ tím hóa đỏ là H2SO4 còn lại là Na2SO4
1.Cho những chất sau: đồng,các hợp chất của đồng và axit sunfuric.Hãy viết những phương trình hóa học điều chế đồng(II) sunfat từ những chất đã cho , cần ghi rõ các điều kiện của phản ứng.
Cu + 2H2SO4 (đặc) -> CuSO4 + SO2 + 2H2O (đk: to)
CuO + H2SO4 -> H2O + CuSO4 (đk: ko có)
Cu(OH)2 + H2SO4 -> 2H2O + CuSO4 (đk: ko có)
CuCO3 + H2SO4 -> CuSO4 + CO2 + H2O (dk: ko có)
2.Có 4 lọ không nhãn,mỗi lọ đựng một dung dịch không màu là HCl, H2SO4,NaCl, Na2SO4. Hãy nhận biết dung dịch đựng trong mỗi lọ bằng phương pháp hóa học.Viết PTHH..
– Cho vài ml dd làm mẫu thử vào từng ống nghiệm và đánh số thứ tự tương ứng.
– Cho 1 mẩu quỳ tím vào từng mẫu thử rồi quan sát:
+ Nếu quỳ tím trong ống nghiệm có màu đỏ thì đó là dd HCl và dd H2SO4 (nhóm A)
+ Nếu quỳ tím không đổi màu thì đó là dd NaCl và dd Na2SO4 (nhóm B)
– Cho vào mỗi mẫu thử nhóm A vài ml dd BaCl2
+ Mẫu thử nào tác dụng với BaCl2 , tạo kết tủa trắng thì đó là dd H2SO4:
PTHH: H2SO4 + BaCl2 –> BaSO4 + 2HCl
+ Mẫu thử không tác dụng với dd BaCl2 thì đó là dd HCl
– Cho vào mỗi mẫu thử nhóm B vài ml dd Ba(OH)2
+ Mẫu thử nào tác dụng với Ba(OH)2 , tạo kết tủa trắng thì đó là dd Na2SO4:
PTHH: Na2SO4 + Ba(OH)2 –> BaSO4 + 2NaOH
+ Mẫu thử không tác dụng với dd Ba(OH)2 thì đó là dd NaCl

a;
Trích các mẫu thử
Cho các mẫu thử lội qua dd Br2 dư nhận ra:
+SO2 tác dụng và ko có khí thoát ra
+Còn lại đều ko tác dụng nên bay ra
Đốt 3 khí còn lại trong không khí nhận ra:
+CO cháy
+2 khí còn lại ko cháy
Cho 2 khí còn lại lội qua dd Ca(OH)2 dư nận ra:
+CO2 tạo ết tủa
+N2 ko PƯ
b;
Fe3O4 + 8HCl -> FeCl2 + 2FeCl3 + 4H2O
Cu + 2FeCl3 -> CuCl2 + 2FeCl2
| 2NaHCO3 | + | Ba(OH)2 | → | 2H2O | + | Na2CO3 | + | BaCO3 |
(nước cx tính là oxit nhé)
Fe + 3AgNO3(dư)-> Fe(NO3)3 + 3Ag

Bài 1:
Phương trình phản ứng điều chế xút từ vôi sống và sô đa
- CaO + H2O --> Ca(OH)2
- Ca(OH)2 + Na2CO3 --> CaCO3 + 2NaOH.
Bài 2:
- Đặt công thức hóa học của kim loại cần tìm là: RO.
- Phương trình hóa học của phản ứng:
RO + 2HCl --> RCl2 + H2O
- Số mol axit HCl: nHClnHCl = 30.14,6100.36,530.14,6100.36,5 = 0,12 mol
- Số mol oxit : nROnRO = 0,12 : 2 = 0,06 mol
- Khối lượng mol của oxit là 4,8 : 0,06 = 80g
- PTK của oxit là RO = 80
- Nguyên tử khối của R bằng: 80 – 16 = 64 đvc.
Vậy R là Cu. Oxit cần tìm là CuO.

2.
CuO + H2 -> Cu + H2O
nCuO=\(\dfrac{48}{80}=0,6\left(mol\right)\)
Theo PTHH ta có:
nCuO=nH2=nCu=0,6(mol)
mCu=64.0,6=38,4(g)
VH2=22,4.0,6=13,44(lít)

- Trích một ít các dd làm mẫu thử, đánh số thứ tự
- Cho 2 dd tác dụng với dd BaCl2
+ Không hiện tượng: NaCl
+ Kết tủa trắng: Na2SO4
Na2SO4 + BaCl2 --> BaSO4\(\downarrow\) + 2NaCl

Bài 1:
Gọi CTHH của oxit là \(A_xO_y\) ( x,y là những số nguyên dương đơn giản )
Vì \(M_{A_xO_y}=160\left(g/mol\right)\)
\(\Rightarrow x.M_A+16y=160\left(g/mol\right)\)
\(\%m_A=70\%\Rightarrow\dfrac{x.M_A}{160}.100\%=70\%\)
\(\Rightarrow x.M_A=112\)
Ta có bảng thử các giá trị của x:
| x | 1 | 2 | 3 |
| \(M_A\) | 112 | 56 | 37,3 |
⇒ x = 2 ; MA = 56 ⇒ Kim loại là Fe
\(y=\dfrac{160-112}{16}=3\)
Vậy CTHH : \(Fe_2O_3\)
Bài 2:
\(n_{H_2SO_4}=\dfrac{49}{98}=0,5\left(mol\right)\)
\(n_{Al_2O_3}=\dfrac{60}{102}=0,59\left(mol\right)\)
PTHH: Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Tỉ lệ : \(\dfrac{0,59}{1}>\dfrac{0,5}{3}\)
→ Nhôm oxit dư, tính theo H2SO4
Theo PTHH : \(n_{Al_2O_3}=\dfrac{1}{3}.n_{H_2SO_4}=\dfrac{1}{3}.0,5=\dfrac{1}{6}\left(mol\right)\)
\(\Rightarrow m_{Al_2O_3p/ư}=\dfrac{1}{6}.102=17\left(g\right)\)
\(\Rightarrow m_{Al_2O_3dư}=60-17=43\left(g\right)\)
Theo PTHH: \(n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{3}.n_{H_2SO_4}=\dfrac{1}{3}.0,5=\dfrac{1}{6}\left(mol\right)\)
\(\Rightarrow m_{AL_2\left(SO_4\right)_3}=\dfrac{1}{6}.342=57\left(g\right)\)

Ta nhúm quỳ
-Quỳ chuyển đỏ :HCl
-Quỳ chuyển xanh NaOH
-Quỳ ko chuyển màu là NaCl , H2O
+Sau đó ta nhỏ AgNO3
-Xuất hiện kết tủa là NaCl
- ko hiện tg :H2O
NaCl+AgNO3->NaNO3+AgCl
Mang đi cô cạn cũng được mà. Chứ lớp 8 chưa học đến phản ứng với AgNO3 :)

Phương trình phản ứng hóa học:
Al2O3 + 3H2SO4 → Al2(SO4) + 3H2O
102 g 3. 98 = 294 g
Theo phương trình phản ứng ta thấy, khối lượng axit sunfuric nguyên chất tiêu thụ lớn gấp hơn hai lần khối lượng oxit. Vì vậy, 49 gam H2SO4 nguyên chất sẽ tác dụng với lượng nhôm (III) oxi nhỏ hơn 60gam
Vật chất Al2O3 sẽ còn dư và axit sunfuric phản ứng hết.
102 g Al2O3 → 294 g H2SO4
X g Al2O3 → 49g H2SO4
Lượng chất Al2O3 còn dư là: 60 – x = 60 - = 43 g
Trần Thu Hà copy từ trang hoc khác đó cô @Cẩm Vân Nguyễn Thị

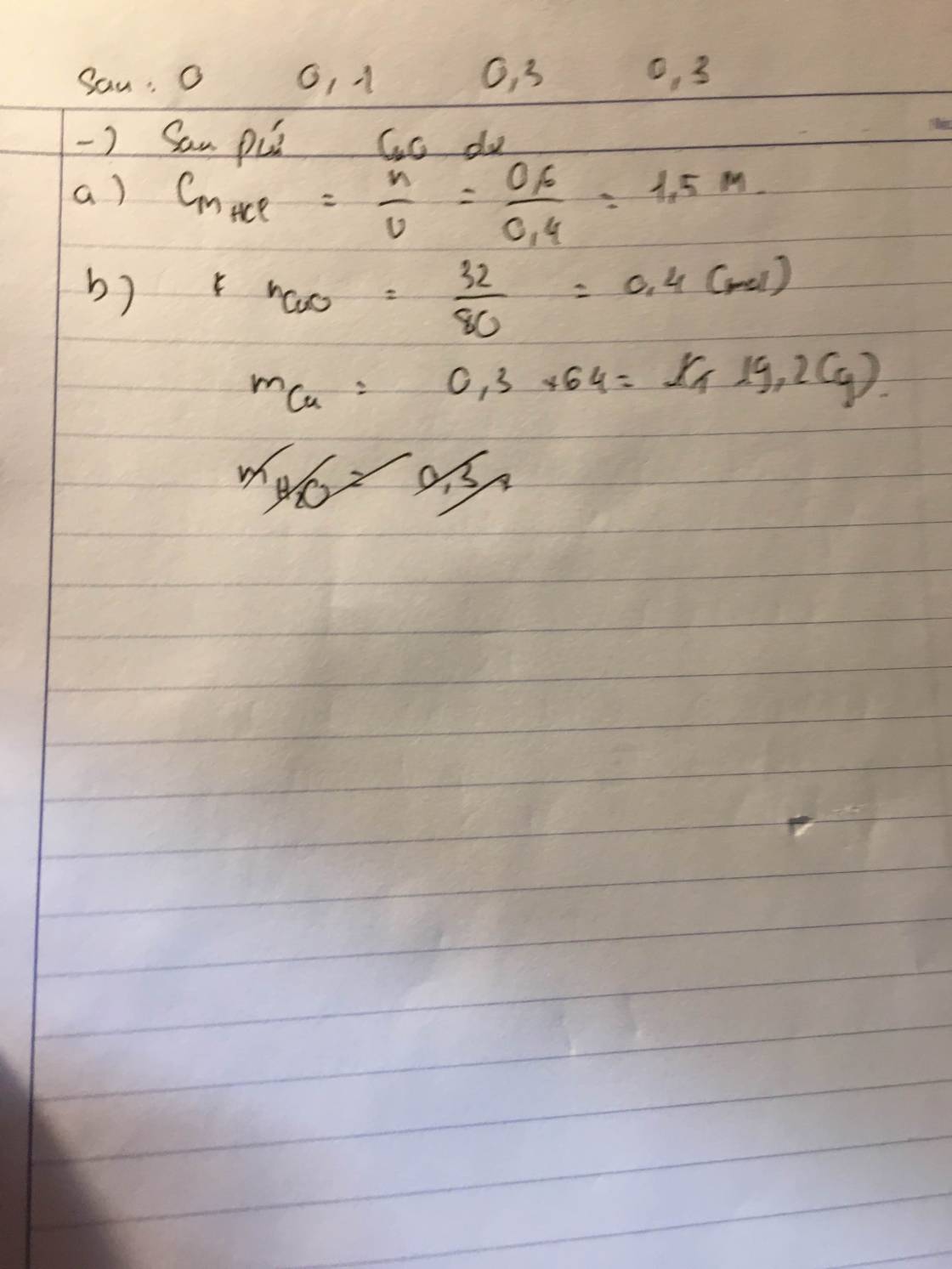
2. -Cho hỗn hợp t/d với dd HCl vì chỉ có Al t/d nên ta sẽ thu được đồng kim loại tinh khiết:
PTHH: 2Al + HCl \(\rightarrow\)2AlCl3+3H2
1. -Thuốc thử: dd H2O, quỳ tím, dd AgNO3.
-Bước 1: Lấy mẫu thử và đánh dấu.
-Bước 2: Cho từng mẫu thử t/d với dd H2O, mẫu thử nào tan thì đó là N2O5, Na2O, còn lại là MgO, NaCl.
PTHH: N2O5+H2O-----> HNO3
PTHH: Na2O +H2O ----> NaOH.
-Bước 3: Cho quỳ tím vào 2 dd, quỳ tím hóa đỏ là N2O5, hóa xanh là Na2O.
-Bước 4: Cho từng mẫu thử t/d với dd AgNO3, mẫu thử nào xuất hiện kết tủa là NaCl, còn lại là MgO.
PTHH: NaCl +AgNO3-----> NaNO3+ AgCl.
-Bước 5: Ghi tên mẫu thử.