Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


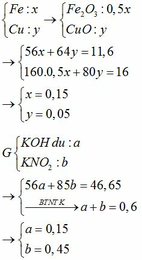
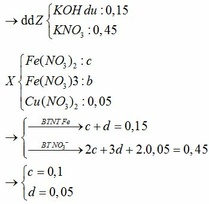

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%

Có: nH2SO4 \(=\frac{4,9}{98}=0,05\left(mol\right)\)
Vì: \(x_1+H2S\text{O4}\rightarrow X_2+X_3\) nên X1 có thể là: oxit bazo, oxit lưỡng tính, bazo, hidroxit lưỡng tính, muối. Nhưng vì bài cho X1 có thể là CaO,MgO,NaOH,KOH,Zn và Fe nên loại các trường hợp oxit lưỡng tính, hidroxit lưỡng tính, muối.
TH1: X1 là oxit bazo: CaO,MgO.
Gọi CTPT chung cho X1 là MgO.
PTPU:
MO + H2SO4 → MSO4 + H2O (*) mol
0,05 0,05 0,05
Vậy KL mol của MO là: \(M_{MO}=\frac{2,8}{0,05}=56\left(g\right)\)
Vậy MO là CaO
TH2: Xét X1 là bazo: NaOH, KOH
Gọi CTPT chung cho X1 là MOH.
PTPƯ: 2MOH + H2SO4 → M2SO4 + 2H2SO4 (**)
0,1 0,05 0,05
Vậy KL mol của MOH là: \(M_{MOH}=\frac{2,8}{0,1}=28\left(g\right)\) (không có MOH thỏa mản)
TH3: X1 kim loại Zn và Fe. Gọi CTCP chung cho X1 là M.
PTPU: M + H2SO4 → MSO4 + H2 (***)
0,05 0,05 0,05
Vậy KL mol MO là \(M_M=\frac{2,8}{0,05}=56\left(g\right)\). Vậy M là Fe.
b. X1 là CaO thì X2 là \(m_{CaS\text{O4}}=0,05.136=6,8\left(g\right)\)
(khác bài ra 7,6 g) loại.
X1 là kim loại Fe thì X2 \(m_{FeS\text{O4}}=0,05.152=7,6\left(g\right)\) phù hợp với đề bài như vậy X3 là H2

a) Na2CO3+2HCl-----> 2NaCl+H2O+CO2
n\(_{CO2}=\frac{0,448}{22,4}=0,02\left(mol\right)\)
Theo pthh
n\(_{Na2CO3}=n_{CO2}=0,02\left(mol\right)\)
m\(_{Na2CO3}=0,02.106=2,12\left(g\right)\)
m\(_{NaCl}=\)5-2,12=2,83(g)
b) mdd sau pư= 5+20-(0,02.44)=24,12(g)
theo pthh
n\(_{NaCl}=2n_{H2}=0,04\left(mol\right)\)
C%=\(\frac{0,04.58,5}{24,12}.100\%=9,7\%\)

a, PT: \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(FeO+H_2SO_4\rightarrow FeSO_4+H_2O\)
Gọi: \(\left\{{}\begin{matrix}n_{CuO}=x\left(mol\right)\\n_{FeO}=y\left(mol\right)\end{matrix}\right.\) ⇒ 80x + 72y = 11,2 (1)
Ta có: \(n_{H_2SO_4}=0,15.1=0,15\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{CuO}+n_{FeO}=x+y=0,15\left(2\right)\)
Từ (1) và (2) ⇒ x = 0,05 (mol), y = 0,1 (mol)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,05.80}{11,2}.100\%\approx35,71\%\\\%m_{FeO}\approx64,28\%\end{matrix}\right.\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{CuSO_4}=n_{Cu}=0,05\left(mol\right)\\n_{FeSO_4}=n_{FeO}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{CuSO_4}}=\dfrac{0,05}{0,15}=\dfrac{1}{3}\left(M\right)\\C_{M_{FeSO_4}}=\dfrac{0,1}{0,15}=\dfrac{2}{3}\left(M\right)\end{matrix}\right.\)

a) \(CaCO_3\rightarrow^{t^0}CaO+CO_2\left(1\right)\)
\(MgCO_3\rightarrow^{t^0}MgO+CO_2\left(2\right)\)
Đặt a, x, y là số gam của Al2O3, CaCO3, MgCO3 trong hỗn hợp X.
Theo gt: \(m_{Al_2O_3}=\dfrac{1}{10}m\left(MgCO_3;CaCO_3\right)\Rightarrow x+y=10a\left(I\right)\)
Vậy mA = 10a + a = 11a gam. ( Chất rắn Y gồm: MgO; CaO; Al2O3
Theo gt: \(m_B=\dfrac{56,80}{100}m_A=6,248a\left(gam\right)\)
Vậy: \(\dfrac{56.x}{100}+\dfrac{40.y}{84}=6,248a-a=5,248a\left(II\right)\)
Giải hệ: \(\left(I;II\right)\Rightarrow x=5,8a\)
Vậy %mCaCO3 = \(\dfrac{5,8a.100}{11a}=52,73\%\)
\(\%m_{Al_2O_3}=\dfrac{a.100}{11a}=9,09\%\)
\(\%m_{MgCO_3}=38,18\%\)
b) Đưa khối lượng hỗn hợp về 100g thì ta có khối lượng chất rắn sau pư là 67g.
mAl2O3=\(\dfrac{100}{100}\cdot10,2\) =10.2 g
mFe2O3=\(\dfrac{100}{100}\cdot9,8\) =9,8 g
mCaCO3= 100-(10.2+9.8)=80g
PTHH: CaCO3 ----t0--> CaO+ CO2
1 1 1
Khối lượng chất rắn hao hụt sau pư là khối lượng CO2.
mCO2=100-67=33g
=>nCO2= 33/44=0.75 mol
mCaCO3=0.75*100=75g
mCaCO3 dư= 80-75=5g
mCaO=0.75*56=42g
%CaCO3=5/67*100=7.46%
%CaO=42/67*100=62.7%
%Al2O3=10.2/67*100=15.2%
=>%Fe2O3=14.64%